黑龙江哈尔滨第三中学2020年高考理综-化学二模试卷
黑龙江哈尔滨第三中学2020年高考理综-化学二模试卷
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
化学与人类生产、生活、社会可持续发展密切相关。下列说法正确的是( )
A . 蛋白质在人体内水解为氨基酸和甘油等小分子物质后才能被吸收
B . 丝绸的主要成分是天然纤维素,属于高分子化合物
C . 高铁车用大部分材料是铝合金,铝合金材料具有质量轻、抗腐蚀能力强等优点
D . 中秋节吃月饼,为防止月饼富脂易变质,常在包装袋中加入生石灰
|
|
| 2. 单选题 | |
|
桥环化合物是指化合物中的任意两个环共用两个不直接相连的碳原子的环烃,二环[1,1,0]丁烷(
A . 其同分异构体中呈环状的只有环丁烯(
|
|
| 3. 单选题 | |
|
短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是所有短周期主族元素中最大的,W的核外电子数与X、Z的最外层电子数之和相等,Y的原子序数是Z的最外层电子数的2倍,由W、X、Y三种元素形成的化合物M的结构如图所示。下列叙述正确的是( )
A . Y单质的熔点高于X单质
B . 元素非金属性强弱的顺序为W>Y>Z
C . Z元素在自然界中既有游离态也有化合态
D . 1moIW 和X形成的化合物中可能含有4mol离子
|
|
| 4. 单选题 | |
|
设NA为阿伏加德罗常数的值。下列有关叙述错误的是( )
A . 乙烯和环丁烷(C4H8)的混合气体共28g含有的原子数目为6NA
B . 0.1 mol羟基中所含有的电子数为NA
C . 1 L0.1 mol·L-1 Na2S溶液中,S2-、 HS-和H2S的微粒数之和为0.1NA
D . 在K37ClO3+6H35Cl(浓)=KCl+3Cl2↑+3H2O反应中,若反应中电子转移的数目为10NA则有424g氯气生成
|
|
| 5. 单选题 | ||||||||||||||||
|
对下列实验现象或操作解释正确的是( )
A . A
B . B
C . C
D . D
|
||||||||||||||||
| 6. 单选题 | |
|
尿素在生产生活中应用非常广泛,2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(l)是工业上合成氮肥尿素的主要方法,在生产条件下,单位时间内获得尿素的产量与压强及n(NH3):n(CO2)的关 系如图甲所示。当氨碳比n(NH3):n(CO2)=4 时,CO2的转化率随时间的变化关系如图乙所示。下列说法错误的是( )
A . 生产过程中n(NH3):n(CO2)的 最佳配比为2:1
B . 若开始投料按照n(NH3):n(CO2)为2:1投料,平衡后若压缩容器的体积,则再次平衡时c(NH3)比压缩前小
C . A点的逆反应速率小于B点的正反应速率
D . 由图乙可知NH3的平衡转化率为30%
|
|
| 7. 单选题 | |
|
常温下,向20mL 0.05mol·L-1的某稀酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。下列分析正确的是( )
A . NaHB溶液可能为酸性,也可能为碱性
B . A,B,C三点溶液的pH是逐渐减小,D,E,F三点溶液的pH是逐渐增大
C . B点溶液c(NH4+)=2c(B2-)
D . E溶液中离子浓度大小关系:c(NH4 +)> c(B2-)> c(H+)>c(OH-)
|
|
| 8. 综合题 | |
|
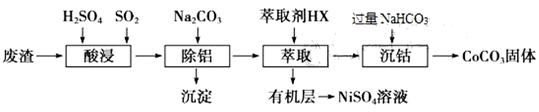
镍、钴及其化合物在工业上应用广泛。从某含镍废渣(含主要成分为Ni、CoO、Co2O3 及少量杂质Al2O3)提取碳酸钴、硫酸镍的工艺如下:
已知:25℃,Ksp[Co(OH)2]=4.0×10-15 , lg2=0.3
|
|
| 9. 实验探究题 | |
|
某研究小组同学为探究锌与硫酸反应生成SO2、H2的临界浓度(浓硫酸能与锌反应生成SO2的最低浓度)设计了如下实验。在大试管A中加入100mLl
8mol/L硫酸,向连接在塑料棒上的多孔塑料球内加入足量的锌粒(塑料棒可以上下移动),在试剂瓶D中加入足量的浓NaOH溶液(加热和夹持装置已省略)。
已知:锌与浓硫酸接触,开始时反应缓慢,可以适当加热以加速其反应,当有大量气泡生成时,该反应速率会明显加快并伴有大量的热放出。
|
|
| 10. 综合题 | |
|
GaN凭借其出色的功率性能、频率性能以及散热性能,在光电领域和高频微波器件应用等方面有广阔的前景。
|
|
最近更新
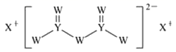


 Ni(OH)2+M(M为储氢合金)电池充电时阳极的电极反应式是。
Ni(OH)2+M(M为储氢合金)电池充电时阳极的电极反应式是。







