四省八校2022届高三下学期开学考试理综化学试题
四省八校2022届高三下学期开学考试理综化学试题
教材版本:化学
试卷分类:化学高三下学期
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
教材版本:化学
试卷分类:化学高三下学期
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
化学与生产、生活、环境密切相关。下列说法正确的是( )
A . 荧光材料BGO的主要成分锗酸铋(Bi2Ge2O7)属于无机非金属材料
B . 活性炭具有还原性,可用于除去水体中Pb2+等重金属离子
C . 棉、丝、羽毛及塑料完全燃烧都只生成CO2和H2O
D . “燃煤脱硫”有利于实现“碳达峰、碳中和
|
|
| 2. 单选题 | |
|
用NA代表阿伏加德罗常数的值,下列说法正确的是( )
A . 20g D216O含中子数目为9NA
B . 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA
C . 密闭容器中2mol NO和1mol O2充分反应后,容器中分子数为2NA
D . 0.25mol Zn与一定量浓硫酸反应后完全溶解,生成气体的分子数小于0.25NA
|
|
| 3. 单选题 | |
|
下列关于有机化合物的叙述正确的是( )
A . 乙烷可以发生取代反应和加成反应
B . 用酸性高锰酸钾溶液可鉴别己烯和甲苯
C . 邻二甲基环己烷(
|
|
| 4. 单选题 | |||||||||||||||||||||
|
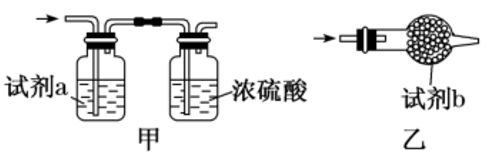
在实验室中制备以下几种气体,除杂实验的试剂、装置选用合理的是( )
A . A
B . B
C . C
D . D
|
|||||||||||||||||||||
| 5. 单选题 | |
|
W、X、Y、Z为原子序数依次增大的短周期元素,X、Y位于同一主族,W的单质在Z的单质中燃烧生成WZ,产生苍白色火焰。甲、乙分别为X、Y的单质,丙、丁分别为Y与W、Y与X形成的二元化合物,它们的转化关系如图所示:
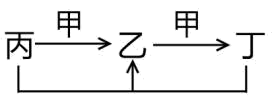 。下列说法正确的是( ) 。下列说法正确的是( )
A . 原子半径:W<X<Y<Z
B . 氧化物对应的水化物的酸性:Y<Z
C . X、Y、Z三种元素组成的化合物水解产物溶于水后,溶液呈酸性
D . X的一种同素异形体和化合物丁均具有漂白性,二者漂白原理相同
|
|
| 6. 单选题 | |
|
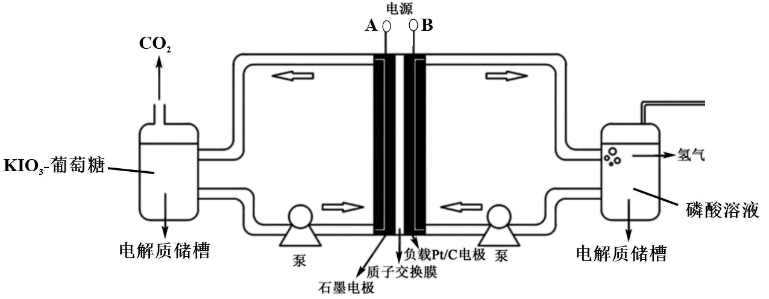
利用生物质来制取氢气是实现生物质清洁利用的一一个重要途径。KIO3催化电解葡萄糖(C6H12O6)制氢实验的装置(如下图所示),电极两侧的电解液在蠕动泵的作用下在电解液储槽和电极间不断循环。下列说法不正确的是( )
A . 电极A为电源正极
B . 电解过程中右侧电解质储槽中的磷酸浓度基本保持不变
C . 电解过程的总方程式为:C6H12O6+6H2O
 6CO2↑+12H2↑
D . 电解时,当有0.4molH+通过质子交换膜时,理论上消耗葡萄糖6.0g 6CO2↑+12H2↑
D . 电解时,当有0.4molH+通过质子交换膜时,理论上消耗葡萄糖6.0g
|
|
| 7. 单选题 | |
|
已知:室温下,Ksp(AgCl)=2.0×10-10;Ksp(AgBr)=5.4×10-13;Ksp(AgI)=8.3×10-17;Ksp(Ag2CrO4)=2.0×10-12 , Ag2CrO4为难溶于水和酸的红色固体。下列说法不正确的是( )
A . 上面四种银盐饱和溶液中,c(Ag+)最大的是Ag2CrO4溶液
B . 用标准AgNO3溶液滴定某溶液中的氯离子含量,可选用K2CrO4作指示剂。
C . 向NaCl和KI混合溶液中加入AgNO3溶液,当两种沉淀共存时,
 4.15×10-7
D . 向AgBr悬浊液加入一定量的NaCl固体后c(Cl-)=10-4mol/L,可使平衡AgBr(s)⇌Ag+(aq)+Br-(aq)正向移动 4.15×10-7
D . 向AgBr悬浊液加入一定量的NaCl固体后c(Cl-)=10-4mol/L,可使平衡AgBr(s)⇌Ag+(aq)+Br-(aq)正向移动
|
|
| 8. 综合题 | |||||||||||||||||||||||||
|
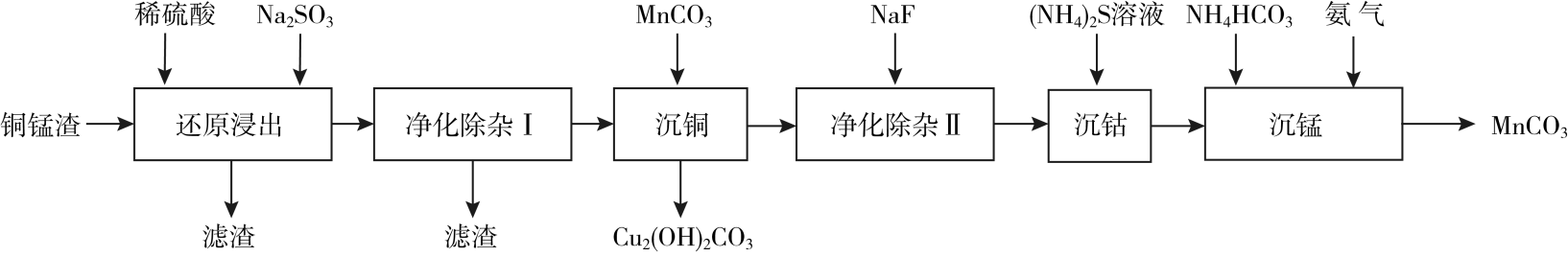
钴产品的湿法生产中会生成大量的铜锰渣,主要含有CuO、MnO2 , 还含有少量的Co2O3、Fe2O3、Al2O3、CaO、MgO等。以铜锰渣为原料制备Cu2(OH)2CO3和MnCO3的工艺流程如下图所示:
已知:相关金属离子形成氢氧化物沉淀的pH范围如下:
|
|||||||||||||||||||||||||
| 9. 实验探究题 | |||||||||||||||
|
化学实验兴趣小组探究不同氛围、不同温度下草酸亚铁晶体(FeC2O4·2H2O)的分解产物。
|
|||||||||||||||
| 10. 综合题 | |
|
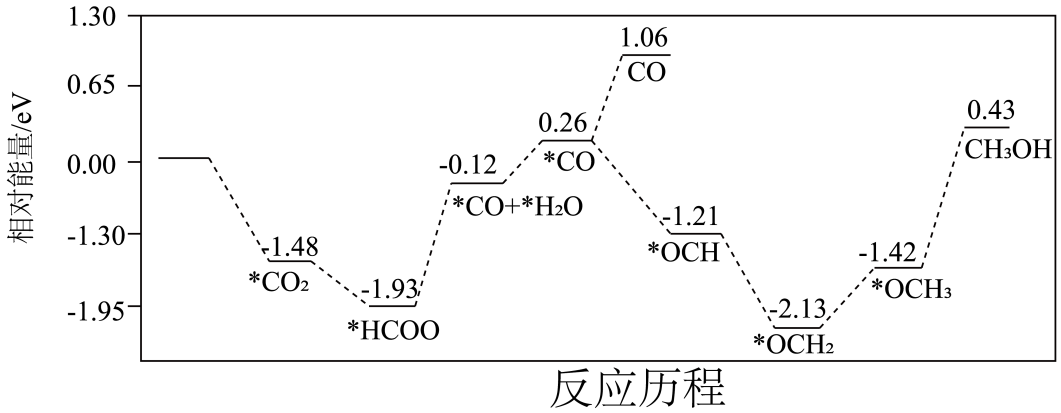
甲醇是重要的化工原料,主要用于精细化工和制造塑料。利用二氧化碳生产甲醇实现CO2资源化,同时减少温室气体的排放。
已知:一定条件下,CO2催化加氢生产甲醇,发生如下反应: 反应i:3H2(g)+CO2(g)⇌CH3OH(g)+H2O(g) ∆H1=-49kJ·mol-1 K1 反应ii:H2(g)+CO2(g)⇌CO(g)+H2O(g) △H2=+41kJ·mol-1 K2
|
|
最近更新
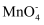 +3Mn2++2H2O=5MnO2↓+4H+),KMnO4溶液盛装在(填“酸式”或“碱式”)滴定管中,重复滴定三次,平均消耗KMnO4标准溶液20.00mL,则MnCO3的纯度为(结果保留4位有效数字)。
+3Mn2++2H2O=5MnO2↓+4H+),KMnO4溶液盛装在(填“酸式”或“碱式”)滴定管中,重复滴定三次,平均消耗KMnO4标准溶液20.00mL,则MnCO3的纯度为(结果保留4位有效数字)。
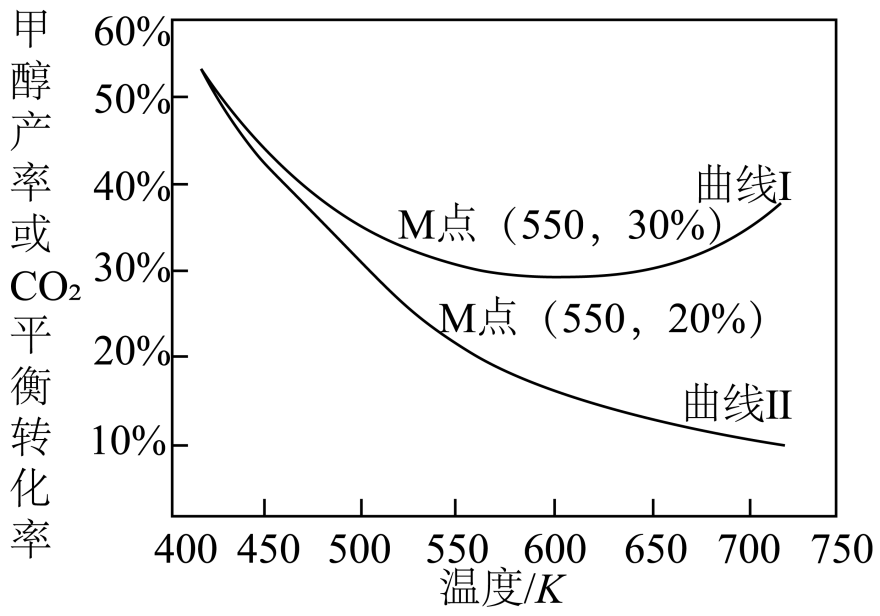
 投入密闭容器中,同时发生反应i和ii,一段时间后,体系中CO2平衡转化率及甲醇产率随温度变化关系如下图所示。
投入密闭容器中,同时发生反应i和ii,一段时间后,体系中CO2平衡转化率及甲醇产率随温度变化关系如下图所示。