初中化学鲁教版九年级下学期 第九单元第二节 金属的化学性质
初中化学鲁教版九年级下学期 第九单元第二节 金属的化学性质
教材版本:化学
试卷分类:化学九年级下学期
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
教材版本:化学
试卷分类:化学九年级下学期
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 综合题 | |
|
回答下列与金属有关的问题。
|
|
| 2. 单选题 | |
|
等质量、等浓度的稀硫酸分别与足量的镁、锌两种金属反应,下列图像能正确表示产生氢气质量与反应时间之间关系的是( )
A .
 B .
B .  C .
C .  D .
D . 
|
|
| 3. 实验探究题 | |
|
某课外小组的同学以“铁、铜、银的化学性质”为课题,进行科学探究活动,请根据已学知识完成下列探究问题。
(提出问题)铁、铜、银的金属活动性顺序是怎样的?
|
|
| 4. 单选题 | |
|
等质量的M、N两种金属,分别与足量稀盐酸反应,生成氢气质量和反应应时间的关系如图所示,下列说法正确的是( )
A . N的金属活动性比M强
B . N生成氢气质量比M多
C . 如果N是铁,M可能是镁
D . N产生氢气的速率更快
|
|
| 5. 单选题 | |
|
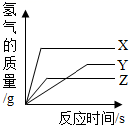
取等质量的X、Y、Z三种金属分别与足量同浓度的稀盐酸反应,都生成+2价盐,反应情况如图,以下叙述正确的是( )
A . 金属活动性由强到弱:X>Y>Z
B . 产生氢气质量:X>Y>Z
C . X、Y、Z依次可能是Mg、Zn、Fe
D . 反应所需时间:X<Y<Z
|
|
| 6. 单选题 | |
|
现有甲、乙、丙三种金属,如果把甲和乙分别放入稀硫酸中,甲溶解并产生H2。乙不反应:如果把乙和丙分别放入硝酸银溶液中,过一会儿,在乙的表面有银析出,而丙没有变化,根据以上事实,则甲、乙、丙的金属活动性由强到弱的顺序是( )
A . 甲>乙>丙
B . 乙>甲>丙
C . 乙>丙>甲
D . 丙>乙>甲
|
|
| 7. 综合题 | |||||||||||||||||||||
|
许多电子元件中都使用了黄铜。为测定某黄铜(假设合金中仅含铜和锌)中铜的质量分数,兴趣小组同学称取20g黄铜粉末于烧杯中,将80g稀硫酸分四次加入,充分反应,测得实验数据如下表所示:
|
|||||||||||||||||||||
| 8. 单选题 | |
|
向CuSO4溶液中加入一定质量的Al粉,充分反应后过滤,得蓝色滤液,并将滤渣晾干(不考虑操作中的损失)。下列说法正确的是( )
A . 滤液中只含有Al2(SO4)3
B . 滤渣的质量等于Al粉的质量
C . 向滤渣中滴加稀盐酸,无气泡产生
D . 发生反应的化学方程式为Al+CuSO4=Cu+Al2(SO4)3
|
|
| 9. 实验探究题 | |||||||||||||
|
化学知识能够破解某些骗局。骗子常用金光闪闪的“假金元宝”(Cu-Zn合金制成)冒充真金,蒙骗贪小便宣之人。“圳创”小组进行了真假元宝的鉴别。
|
|||||||||||||
| 10. 实验探究题 | |
|
一般情况下,金属活动性越强,与酸反应的速度越快。为了探究金属镁、锌、铁与酸反应的快慢,某研究性学习小组设计了如下的实验。
(实验步骤) ①取A、B、C三支试管,分别加入2mL浓度相同的盐酸。 ②分别将过量的、颗粒大小相同的镁、锌、铁三种金属粉末,放入相同的气球中。 ③小心的把三个气球分别套在各个试管口上,如图所示。 ④分别将三种金属粉末倒入试管中。 (实验预测与分析)
|
|
最近更新