山西省大同、阳泉市2022届高三第二次模拟考试理科综合化学试题
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
2022北京冬奥会中使用了很多高新材料,如冬奥会颁奖礼服内胆使用了第二代石墨烯发热材料;速滑竞赛服使用了高性能合成纤维和聚酯材料;火炬“飞扬”使用了新型碳纤维树脂复合材料。下列有关材料的说法错误的是( )
A . 石墨烯、金刚石、石墨互为同素异形体
B . 合成纤维与碳纤维均属于有机高分子材料
C . 聚酯是由多元醇和多元酸缩聚而得的高分子聚合物
D . 一般树脂材料耐火性较差,但“飞扬”的新型碳纤维树脂复合材料具有较高的耐火性
|
|
| 2. 单选题 | |
|
NA为阿伏加德罗常数的值。下列说法正确的是( )
A . 12gl4C含有的质子数为6NA
B . 1molH2(g)与1molI2(g)反应生成HI(g),反应后气体分子数为2NA
C . 已知核反应:
 X+ X+ n→ n→ Y+ Y+ He则10gX的中子数为10NA
D . 64gCu与含过量H2O2的稀硫酸反应,此过程转移的电子数为2NA He则10gX的中子数为10NA
D . 64gCu与含过量H2O2的稀硫酸反应,此过程转移的电子数为2NA
|
|
| 3. 单选题 | |
|
丙三醇无色、无臭、味甜,外观呈澄明黏稠液态,是一种有机物,俗称甘油。下列是合成甘油的一条路线:
下列说法正确的是( )
A . 甘油的化学式为C3H7O3
B . 丙三醇与2-丁醇互为同系物
C . 环丙烷的同分异构体所有碳原子共平面
D .
 转化成 转化成 消耗3molNaOH 消耗3molNaOH
|
|
| 4. 单选题 | ||||||||||||||||
|
下列实验设计能达实验目的的是( )
A . A
B . B
C . C
D . D
|
||||||||||||||||
| 5. 单选题 | |
|
W、X、Z、Y为原子序数依次增大的短周期主族元素,Z与X最外层电子数之和是Y的最外层电子数的两倍,W与X可形成原子个数比为3:1的18e-分子。下列说法正确的是( )
A . 简单离子半径:Z>Y>W
B . 氢化物沸点:Z>X
C . X与Z形成的化合物均可以用排空气法收集
D . Y的某种氧化物的水化物可形成二元酸
|
|
| 6. 单选题 | |
|
常温下,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1的一元酸HX溶液和HY溶液(两溶液水的电离程度:HX>HY,当Ka≤10-5时可以认为电解质达到电离平衡时的浓度近似等于起始浓度),其滴定曲线如图所示
已知:弱电解质在溶液里达到电离平衡时,已电离的电解质分子数占起始时总分子数的百分数称为电离度,下列说法正确的是( )
A . 曲线I和II对应的酸分别为HY和HX
B . 相比曲线I,曲线II选用酚酞作终点指示剂误差更小
C . 把曲线上加入40mLNaOH溶液的点称为E点,则B1、C1和E三点溶液中由水电离出的c(H+)大小关系为C1>E>B1
D . 0.01mol/L弱酸HX和HY电离度之比为1:10
|
|
| 7. 单选题 | |
|
我国科学家以CO2作为无机碳源,通过熔融盐电解技术成功制备出一种核壳结构催化剂Co@C(Co@C在N极区生成),其可用于过氧单硫酸盐(PMS)活化降解邻苯二甲酸二乙酯(DEP)污染物。Co@C的熔融盐电解装置与原理图如下:
下列说法正确的是( )
A . N极反应式之一为Co3++e-=Co2+
B . Li+、Na+、K+移向M极
C . 当生成22.4LO2时,转移电子数为4NA
D . 该装置中不存在O2-的生成
|
|
| 8. 综合题 | |
|
学习小组在实验室中设计利用铬钒废水(主要成分为Na3VO4、Na2CrO4)制备新型光催化剂钒酸铁和颜料Cr2O3的流程如下。
已知:(NH4)2S2O8具有强氧化性,不稳定易分解。 回答下列问题:
|
|
| 9. 综合题 | |
|
四氧化三锰用于电子工业生产软磁铁氧体,用作电子计算机中存储信息的磁芯。以工业硫酸锰为原料(含有少量CaO、MgO、Ca(OH)2等物质)制备Mn3O4的工艺流程如下:
已知:①氧化时鼓入空气使溶液的电位迅速上升; ②四氧化三锰中锰的化合价与四氧化三铁中铁的化合价类似。 回答下列问题:
|
|
| 10. 综合题 | |||||||||||||||||||||||||||||||||||||||||||||||
|
我国中科院天津工业生物所利用光伏发电,将电解水获得的H2与CO2反应合成甲醇,再由甲醇经若干醇促反应合成淀粉,首次在实验室实现二氧化碳到淀粉的从头合成,相关论文在国际学术期刊《自然》上发表。回答下列问题:
|
|||||||||||||||||||||||||||||||||||||||||||||||
- 安徽省马鞍山市2019-2020学年高一下学期化学期末考试试卷
- 2016年黑龙江省大庆市高考化学一模试卷
- 2015-2016学年河南省洛阳市孟津一中高二上学期期末化学试卷
- 2015-2016学年广西桂林市临桂中学高二下学期期中化学试卷
- 2015-2016学年山东省菏泽市高一上学期期中化学试卷(A卷)
- 专题13:反应热
- 2015-2016学年河北省邯郸市荀子中学高一下学期期中化学试卷
- 江西省新余市2017-2018学年高考理综-化学二模考试试卷
- 广东省华美实验学校2019-2020学年高一上学期化学第一次月考试卷
- 浙江省温州十五校联合体2019-2020学年高一上学期化学期中考试试卷
- 2015-2016学年陕西省渭南市澄城县寺前中学高二下学期期中化学试卷
- 浙江省温州十校联合体2018-2019学年高一上学期化学期末考试试卷






 与Na2S2O3溶液反应的离子方程式。
与Na2S2O3溶液反应的离子方程式。

 →S4O
→S4O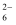 +2I-)至终点,消耗Na2S2O3溶液30.00mL。
+2I-)至终点,消耗Na2S2O3溶液30.00mL。




 CH3OH(g)+H2O(g)△H1
CH3OH(g)+H2O(g)△H1


