广东省茂名市2017-2018学年高三理综-化学第二次模拟考试试卷
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
化学与生活、生产密切相关。下列叙述正确的是( )
A . 酯在碱性条件下的水解反应叫皂化反应
B . 橡胶、合成塑料、合成纤维均是人工合成的高分子材料
C . 古代四大发明中“黑火药”的成分是“一硫二硝三木炭”,这里的“硝”指的足硝酸
D . 《天工开物》记载:“凡埏泥造瓦,掘地二尺余,择取无沙粘土而为之”。“瓦”,传统无机非金属材料,主要成分为硅酸盐
|
|
| 2. 单选题 | |
|
设NA为阿伏加德罗常数的值。下列有关叙述正确的是( )
A . 6.8 g熔融的KHSO4中含有的离子数为0.15 NA
B . 标准状况下,11.2 L乙酸中含有的碳碳键数为0.5NA
C . N2(g)+3H2(g)=2NH3(g)△H=-92.4 kJ/mol,当转移的电子数为6NA时,该反应放 出 92.4 kJ的热量
D . 常温常压下,4.4gCO2和N2O混合气体中含有的原子总数为0.6NA
|
|
| 3. 单选题 | |
|
有机物的结构可用“键线式”简化表示,如:CH3-CH=CH-CH3可表示为
A . X的分子式为C8H8O3
B . 有机物Y足X的同分异构体,含有苯环、能与NaHC03溶液反应、且有三个取代基,则Y的结构有8种
C . X分子中的所有原子不可能在同一平面内
D . X能发生加成反应,取代反应,并能使溴水、酸性KMnO4溶液褪色
|
|
| 4. 单选题 | |||||||||||||||||||||
|
下列实验操作、现象和结论均正确的是( )
A . A
B . B
C . C
D . D
|
|||||||||||||||||||||
| 5. 单选题 | |
|
H2S是一种剧毒气体,如图为质子膜H2S燃料电池的示意图,可对H2S废气资源化利用。下列叙述错误的是( )
A . a是负极,电池工作时,电子的流动力向是:电极a-负载一电极b-质子膜一电极a
B . 电池工作时,化学能转化为电能和热能
C . 电极b上发生的电极反应式为O2+ 4e-+4H+=2H2O
D . 当电路中通过4mol电子时,有4molH+经质子膜进入正极区
|
|
| 6. 单选题 | |
|
前20号元素M、W、X、Y、Z的原子序数依次增大,M和W形成的某种化合物可作制冷剂,Y 和Z能形成ZY2型离子化合物,其电子总数为38。下列有关叙述正确的是( )
A . W和X形成的化合物只有5种
B . M和W可以形成离子化合物
C . W、X、Y三种元素的简单氢化物的沸点:Y>X>W
D . X和Z形成的化合物ZX2中,阳离子和阴离子的数目之比为1:2
|
|
| 7. 单选题 | |||||||||
|
已知部分弱酸的电离平衡常数如下表:
下列叙述错误的是( )
A . NaCN溶液中通入少量CO2发生的离子反应为:CN-+H2O+CO2=HCN+HCO3-
B . 等体积、等物质的量浓度的HCOONa和NaCN溶液中所含阴离子总数前者大于后者
C . 等物质的量浓度的NaHCO3和Na2CO3混合溶液中:c(Na+)>c(OH-)>c(HCO3-)>c(CO32-)>c(H+)
D . 中和等体积、等pH的HCOOH溶液和HCN溶液消耗NaOH的物质的量前者小于后者
|
|||||||||
| 8. 综合题 | |
|
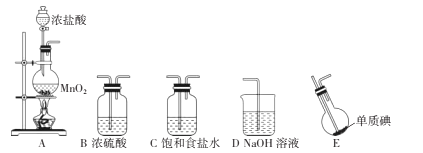
ICl(氯化碘)红棕色液体,熔点13.9℃,沸点97 4℃,易水解,接触空气时能形成五氧化二碘,能与许多单质发生作用,溶于乙醇、乙醚等。某校研究性学习小组的同学拟用下列仪器制备氯化碘。回答下列问题:
|
|
| 9. 综合题 | |||||||||||
|
电解法生产锰时会产生大量的阳极泥,其主要成分为MnO2和Pb,还含有少量其他金属化合物。下图是回收电解锰阳极泥生产MnCO3的工艺流程。
已知:Al(OH)3、Mn(OH)2、MnCO3的Ksp分别为1.0×10-33、1.9×10-13、2.2×10-11。
|
|||||||||||
| 10. 实验探究题 | |||||||||||||
|
甲醇是一种可再生能源,具有开发和应用的广阔前景,其合成反应为CO(g)+2H2(g)
 CH3OH(g)。 CH3OH(g)。
|
|||||||||||||
 Si+2CO↑
Si+2CO↑




 减小
减小


