广东省华南师范大学附中2019-2020学年高三上学期化学第三次月考试卷
广东省华南师范大学附中2019-2020学年高三上学期化学第三次月考试卷
教材版本:化学
试卷分类:化学高三上学期
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
教材版本:化学
试卷分类:化学高三上学期
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3 , 不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:
下列说法错误的是()
A . 溶解烧渣选用足量硫酸,试剂X选用铁粉
B . 固体1中一定含有SiO2 , 控制pH是为了使Al3+转化为Al(OH)3 , 进入固体2
C . 从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D . 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
|
|
| 2. 单选题 | |
|
下列有关物质性质与用途都正确且具有对应关系的是( )
A . ClO2具有强氧化性,可用于水消毒剂
B . 石英熔点高,可用于制造石英研钵
C . 氢氧化铝受热易分解,可用作胃酸中和剂
D . 生石灰能与水反应,可用于干燥氯气
|
|
| 3. 单选题 | |
|
NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A . 12g金刚石中含有的共价键数为4NA
B . 7g超重甲基(—CT3)中含有的电子数为3NA
C . 标准状况下,22.4L氩气中含有的原子数约为2NA
D . 0.1molNa2O2与SO2完全反应转的电子数为0.1NA
|
|
| 4. 单选题 | |
|
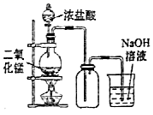
下列实验方案能到实验目的的是( )
A . 制备纯净干燥的Cl2
 B . 证明锌比铜活泼
B . 证明锌比铜活泼 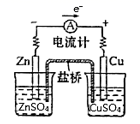 C . 制备无水氯化亚铁
C . 制备无水氯化亚铁 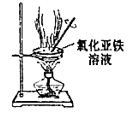 D . 证明一水合氨是一元碱
D . 证明一水合氨是一元碱 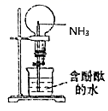
|
|
| 5. 单选题 | |
|
一种高分子可用作烹任器具、电器、汽车部件等材料,其结构片段如图。
下列关于该高分子的说法正确的是( )
A . 该高分子是苯酚的同系物
B . 该高分子在碱性条件下可发生水解反应
C . 该高分子可由甲醛、对甲基苯酚缩合生成
D . 该高分子的结构简式为

|
|
| 6. 单选题 | |||||||||
|
有X、Y、Z、W四种短周期主族元素,它们在周期表中的位置如图所示,已知Y是地壳中含量最高的金属元素,则下列说法中正确的是( )
A . 简单离子半径:Y>W
B . Y的最高价氧化物的水化物和X的最高价氧化物的水化物可反应
C . X的简单氢化物比Z的简单氢化物更稳定、沸点更高
D . 非金属性:W>X
|
|||||||||
| 7. 单选题 | |
|
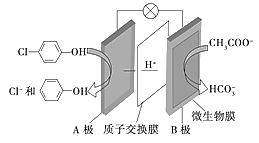
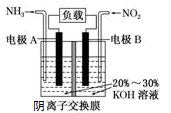
利用反应6NO2+8NH3=7N2+12H2O设计的电池装置如图所示,该装置既能有效消除氮氧化物的排放减轻环境污染,又能充分利用化学能。下列说法正确的是( )
A . 电池工作时,OH—从左向右迁移
B . 电极A上发生氧化反应,电极A为正极
C . 当有0.1molNO2被处理时,外电路中通过电子0.4mol
D . 电极B的电极反应式为2NO2+8e-+8H+=N2+4H2O
|
|
| 8. 综合题 | |
|
镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺路线:
已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。
|
|
| 9. 实验探究题 | |
|
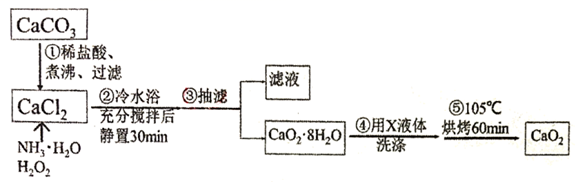
过氧化钙(CaO2)微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂。以下是一种制备过氧化钙的实验方法。回答下列问题:
I.过氧化钙的制备。流程如下,步骤②的装置示意图为图一:
|
|
| 10. 综合题 | |
|
|
最近更新
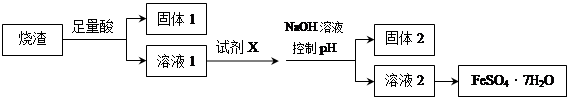


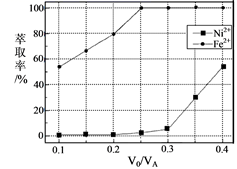
 )对溶液中Ni2+、Fe2+的萃取率影响如图所示,
)对溶液中Ni2+、Fe2+的萃取率影响如图所示,