云南省大理州漾濞一中2019-2020学年高三上学期化学开学考试试卷
云南省大理州漾濞一中2019-2020学年高三上学期化学开学考试试卷
教材版本:化学
试卷分类:化学高三上学期
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
教材版本:化学
试卷分类:化学高三上学期
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
一定条件下能与苯发生化学反应的物质是( )
A . H2
B . 溴水
C . NaOH溶液
D . KMnO4酸性溶液
|
|
| 2. 单选题 | |
|
下列分类或归类正确的是( )
①液氯、氨水、干冰、碘化银均为纯净物 ②CaCl2、NaOH、HCl、IBr均为化合物 ③明矾、水银、烧碱、硫酸均为强电解质 ④C60、C70、金刚石、石墨均为碳的同素异形体 ⑤碘酒、淀粉、水雾、纳米材料均为胶体.
A . ①③④
B . ②③
C . ②④
D . ②③④⑤
|
|
| 3. 单选题 | |
|
在CO2中,Mg燃烧生成MgO和C.下列说法正确的是( )
A . 元素C的单质只存在金刚石和石墨两种同素异形体
B . Mg、MgO中镁元素微粒的半径:r(Mg2+)>r(Mg)
C . 在该反应条件下,Mg的还原性强于C的还原性
D . 该反应中化学能全部转化为热能
|
|
| 4. 单选题 | |
|
关于某混合物的说法正确的是( )
A . 物质的组成元素一定是两种或两种以上
B . 构成物质一定是化合物
C . 构成物质一定是单质
D . 构成物质可能只有一种元素
|
|
| 5. 单选题 | |||||||||||||||||||||
|
下面是溶解性表中的部分内容(室温下测定):
下列有关说法中正确的是( )
A . ①处物质属于可溶性碱
B . ②处物质组成为Fe2(SO3)3
C . ③处物质为硫酸盐或者铜盐
D . ①、③处物质在溶液中发生的反应一定是Cu2++2OH-=Cu(OH)2↓
|
|||||||||||||||||||||
| 6. 单选题 | |
|
下图装置(Ⅰ)是一种可充电电池,装置(Ⅱ)为电解池。
装置(Ⅰ)的离子交换膜只允许Na+通过,已知电池充放电的化学方程式为2Na2S2+NaBr3化气
A . 闭合开关K时,钠离子从右到左通过离子交换膜
B . 闭合开关K时,负极反应式为:3NaBr-2e-=NaBr3+2Na+
C . 闭合开关K时,X电极反应式为:2Cl--2e-=Cl2↑
D . 闭合开关K时,当有0.1molNa+通过离子交换膜,X电极上析出标准状况下气体1.12L
|
|
| 7. 单选题 | |
|
常温时,下列叙述正确的是( )
A . pH=9的NH4Cl与NH3•H2O混合溶液中c(Cl-)>c(NH4+)
B . pH=2.5的可乐中c(H+)是pH=3.5的柠檬水中c(H+)的10倍
C . AgCl在0.1mol/LCaCl2溶液和0.1mol/L NaCl溶液中的溶解度相同
D . 1 mL 1mol/L Na2CO3溶液加水稀释至100mL,pH和Kw均减小
|
|
| 8. 实验探究题 | |
|
工业尾气中的氮氧化物常用氨催化吸收法,原理是NH3与NOx反应生成无毒物质。某同学采用以下装置和步骤模拟工业上氮氧化物的处理过程。
(一)提供的装置 (二)NH3的制取
|
|
| 9. 综合题 | |
|
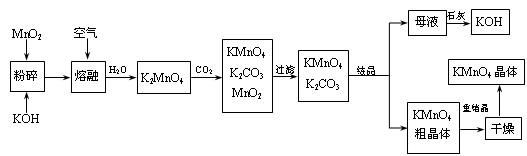
高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
|
|
| 10. 推断题 | |||||||||
|
下表为元素周期表的一部分。
回答下列问题:
|
|||||||||
最近更新
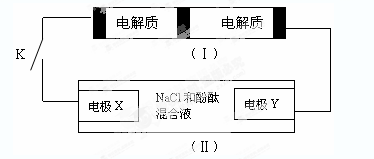
 Na2S4+3NaBr。当闭合开关K时,X电极附近溶液变红。下列说法正确的是( )
Na2S4+3NaBr。当闭合开关K时,X电极附近溶液变红。下列说法正确的是( )