四川省攀枝花市2021年高考化学一模试卷
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
化学与生产、生活密切相关,下列叙述错误的是( )
A . 石灰石可用作燃煤的脱硫剂
B . 过氧化氢溶液可用作医用消毒剂
C . 碳酸钡可用作胃肠X射线透视的造影剂
D . 硫化钠可用作去除废水中Pb2+的沉淀剂
|
|
| 2. 单选题 | |
|
NA是阿伏加德罗常数的值。下列说法正确的是( )
A . 标准状况下,2.24L四氯化碳含共价键总数为0.4NA
B . 由H218O与D216O组成的4.0g混合物含中子数为2NA
C . 由NO2与N2O4组成的4.6g混合气体含氮原子数为0.5NA
D . 标准状况下,溶有6.72LSO2的水中HSO
 与SO 与SO  的微粒数目之和为0.3NA 的微粒数目之和为0.3NA
|
|
| 3. 单选题 | |
|
我国科学家在研究“催化还原地下水硝酸盐污染”时,将甲酸(HCOOH)在纳米级磁性Fe3O4-Pd(钯)表面分解为活性氢气和二氧化碳后,再经a、b两个反应过程实现了NO3-的催化还原(如图)。下列说法错误的是( )
A . 过程a、b中完全还原1molNO
 消耗2molH2
B . Fe3O4催化完成后,可利用Fe3O4的磁性与水体分离
C . HCOOH分解产生CO2可调节反应体系pH,保证催化还原的效果
D . b过程反应的离子方程式为3H2+2NO 消耗2molH2
B . Fe3O4催化完成后,可利用Fe3O4的磁性与水体分离
C . HCOOH分解产生CO2可调节反应体系pH,保证催化还原的效果
D . b过程反应的离子方程式为3H2+2NO  +2H+ +2H+  N2+4H2O N2+4H2O
|
|
| 4. 单选题 | |
|
锌电池具有成本低、安全性强、可循环使用等优点。一种新型锌电池的工作原理如图所示(凝胶中允许离子生成或迁移)。下列说法正确的是( )
A . 充电过程中,a电极发生还原反应
B . 充电过程中,b电极反应为:Zn2++2e-=Zn
C . 放电过程中,SO
 向a极迁移
D . 放电过程中,转移0.4mole-时,a电极消耗0.8molH+ 向a极迁移
D . 放电过程中,转移0.4mole-时,a电极消耗0.8molH+
|
|
| 5. 单选题 | |||||||||||||||||||||
|
根据下列实验操作、现象得出的结论中,正确的是( )
A . A
B . B
C . C
D . D
|
|||||||||||||||||||||
| 6. 单选题 | |
|
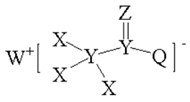
某种化合物的结构如图所示,其中X、Y、Z、Q、T、W为原子序数在20以内且原子序数依次增大的六种主族元素,Z、Q属于同一主族,W+与Q2-具有相同的电子层结构。下列说法错误的是( )
A . 在溶液中,W2YZ3与XTZ反应生成YZ2
B . 该化合物中含有离子键、极性键、非极性键
C . Y、Q、T的最高价氧化物对应水化物的酸性:T>Q>Y
D . Y、Z、Q、T分别与X形成的简单化合物中,Z的化合物沸点最高
|
|
| 7. 单选题 | |
|
已知:常温下CH3COOH的电离常数K=1.8×10-5 , 常温下,在三元弱酸H3R的水溶液中H3R、H2R-、HR2-、R3-的分布分数δ(含R元素微粒占全部含R粒子的物质的量分数)随pH的变化如图所示。下列说法中正确的是( )
A . Na2HR溶液呈酸性
B . 常温下,HR2-的电离常数数量级为10-11
C . 常温下,0.1mol/LCH3COOH溶液的pH比0.1mol/LH3R溶液的pH大
D . 用H3R溶液与NaOH溶液反应制取NaH2R,可用酚酞作指示剂
|
|
| 8. 实验探究题 | |
|
高纯碘化钠晶体是核医学、大型安防设备、暗物质探测等领域的核心材料。某研究小组在实验室制备高纯NaI的简化流程如图:
已知:①I2(s)+I-(aq) ②水合肼(N2H4•H2O)具有强还原性,可将各种价态的碘还原为I- , 氧化产物为N2。 ③NaI易溶于水,也易溶于酒精,在酒精中的溶解度随温度的升高增加不大。 回答下列问题:
|
|
| 9. 综合题 | |
|
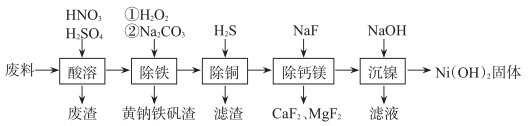
氢氧化镍[Ni(OH)2]常用于制备金属镍及镍的重要化合物。一种用铁镍合金废料(还含有少量铜、钙、镁、硅的氧化物)制备纯度较高氢氧化镍的工艺流程如下:
已知:H2S的电离常数K1=1.3×10-7 , K2=7.1×10-15;Ksp[CuS]=6.0×10-36;Ksp[Ni(OH)2]=1.0×10-15.6 回答下列问题:
|
|
| 10. 综合题 | |
|
CO2制甲醇是极具前景的资源化研究领域。CO2制甲醇有多种方法,其中CO2催化加氢的主要反应是:
Ⅰ.CO2(g)+3H2(g) Ⅱ.CO2(g)+H2(g) 回答下列问题:
|
|



 I
I  反应的离子方程式为。
反应的离子方程式为。
 超过标准,步骤Ⅲ中的多步操作为:
超过标准,步骤Ⅲ中的多步操作为: 

 +2e-=,
+2e-=, 



