河南省新乡市2022届高三第三次模拟理科综合化学试题
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | ||||||||||||||||
|
下列关于我国最新科技成果的化学解读错误的是( )
A . A
B . B
C . C
D . D
|
||||||||||||||||
| 2. 单选题 | |
|
20世纪40年代,传统法合成己二酸工艺就已成熟,一直沿用至今。2020年我国科学家利用8种酶采用“一锅催化法”高效绿色合成了己二酸,其流程如图:
下列说法错误的是( )
A . 温度越高,上述2种方法合成己二酸的速率越快
B . 传统法合成己二酸会产生大气污染物,原子利用率低
C . “一锅催化法”属于绿色化学工艺
D . 1mol己二酸与足量NaHCO3反应生成88gCO2
|
|
| 3. 单选题 | |||||||||||||
|
碘仿(CHI3)是一种外用消毒剂。某实验小组通过电解KI和丙酮(CH3COCH3)来制备碘仿。制得的粗碘仿中含少量石墨粉,分离提纯碘仿的操作中,下列仪器没有用到的是( )
已知几种物质的部分性质如表所示:
A .
 C .
C .  D .
D . 
|
|||||||||||||
| 4. 单选题 | |
|
设
 为阿伏加德罗常数的值。下列说法正确的是( ) 为阿伏加德罗常数的值。下列说法正确的是( )
A . 工业上电解
 制备 制备 时,产生气体的分子数为3 时,产生气体的分子数为3 B .
B .  三硫化四磷( 三硫化四磷( , 如图所示)中含有的极性键的数目为6 , 如图所示)中含有的极性键的数目为6 C . 标准状况下,22.4L氯气与足量烧碱溶液反应,转移的电子数为2
C . 标准状况下,22.4L氯气与足量烧碱溶液反应,转移的电子数为2 D .
D .  与足量乙醇在一定条件下反应,生成的酯基的数目为2 与足量乙醇在一定条件下反应,生成的酯基的数目为2
|
|
| 5. 单选题 | |
|
我国科学家研发出一种绿色锌碘单液流二次电池,工作原理如图所示。下列说法错误的是( )
A . 放电时,聚烯烃多孔电极上发生氧化反应
B . 放电时,K+向多孔石墨电极迁移
C . 充电时,阳极反应式为2I--2e-=I2
D . 充电时,阴极净增65g时a区净增2mol离子
|
|
| 6. 单选题 | |
|
我国科学家开发出一种离子液体(EMIES),该物质由原子序数依次增大的短周期元素X、Y、Z、R、W组成,结构如图所示,只有Y、Z、R位于同一周期,R、W原子的最外层电子数相等。下列说法正确的是( )
A . 原子半径:Y>Z>R>W>X
B . W的氧化物对应的水化物一定是强酸
C . EMIES中,Z、Y原子的最外层都达到8电子结构
D . 由X、Z、R三种元素组成的化合物只有两种
|
|
| 7. 单选题 | |
|
已知:AgA、Ag2B都是难溶盐。室温下,向体积均为10mL、浓度均为0.1mol·L-1的NaA溶液、Na2B溶液中分别滴加0.1mol·L-1的AgNO3溶液,溶液中pX与AgNO3溶液体积的关系如图所示[已知:pX=—lgc(A—)或—lgc(B2—)]。下列推断错误的是( )
A . 室温下,Ksp(Ag2B)=4×10-3a
B . 对应溶液中c(Ag+):e>f
C . 室温下,溶解度:S(AgA)<S(Ag2B)
D . 若c(AgNO3)变为0.05mol·L-1 , 则c点向e点移动
|
|
| 8. 综合题 | |
|
铂钌催化剂是甲醇燃料电池的阳极催化剂。一种以钌矿石[主要含Ru(CO3)2 , 还含少量的FeO、MgO、RuO4、CaO、SiO2]为原料制备钌(Ru)的流程如图。回答下列问题:
|
|
| 9. 实验探究题 | ||||||||||||||||||||||
|
苯硫酚
 是一种局部麻醉剂。某小组拟制备苯硫酚并探究其性质,已知相关物质的部分信息如下表所示: 是一种局部麻醉剂。某小组拟制备苯硫酚并探究其性质,已知相关物质的部分信息如下表所示:
操作步骤: ①向三口烧瓶中加入 ②再向三口烧瓶中慢慢加入 ③撤去水浴B,微热三口烧瓶,并保持一定的回流。反应平稳后,再加热 ④将反应后的混合液进行水蒸气蒸馏,分出苯硫酚,如图2。 ⑤加入氯化钙,经操作X得粗品 回答下列问题:
|
||||||||||||||||||||||
| 10. 综合题 | |||||||||||||||||||||||||||||||||||||||
|
氮氧化物治理是环境学家研究的热点之一。回答下列问题:
|
|||||||||||||||||||||||||||||||||||||||
- 人教版化学高二选修1第一章第四节维生素和微量元素同步练习
- 上海市虹口区2016-2017学年高考化学二模考试试卷
- 2015-2016学年江西省联考高一上学期期中化学试卷
- 江苏省连云港市2019-2020学年高二下学期化学期末考试试卷
- 吉林省白城市通榆县第一中学2019-2020学年高二上学期化学第一次月考试卷
- 广东省汕头市潮师高级中学2016-2017学年高三上学期化学期中考试试卷
- 福建省南平市2017-2018学年高一下学期化学期末考试试卷
- 2016-2017学年甘肃省平凉市静宁县甘沟中学高二上学期期中化学试卷
- 辽宁省锦州市经济技术开发区(滨海新区) 2018-2019学年上学期11月-12月高三化学月考测试卷
- 2016年四川省高考化学模拟试卷
- 2016-2017学年山西省太原市高一下学期期中化学试卷
- 人教版化学高二选修4第三章第四节难溶电解质的溶解平衡同步练习







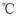




 冰和
冰和 浓硫酸。
浓硫酸。 苯磺酰氯,尽快地分次加入
苯磺酰氯,尽快地分次加入 锌粉,继续反应
锌粉,继续反应 , 温度保持在
, 温度保持在 左右,如图1。
左右,如图1。 。
。 。再进行蒸馏,收集馏分,得纯品
。再进行蒸馏,收集馏分,得纯品 。
。 。
。
 溶液中,振荡,溶液褪色,说明苯硫酚具有(填“氧化”或“还原”)性。
溶液中,振荡,溶液褪色,说明苯硫酚具有(填“氧化”或“还原”)性。


 N2(g)+2CO2(g)。达到平衡后,再充入amolNO(g)和amolCO(g),NO的平衡转化率(“增大”、“减小”或“不变”,下同),气体总压强。
N2(g)+2CO2(g)。达到平衡后,再充入amolNO(g)和amolCO(g),NO的平衡转化率(“增大”、“减小”或“不变”,下同),气体总压强。 )
)



