贵州省安顺市普通高中2018-2019学年高三上学期化学期末考试试卷
教材版本:化学
试卷分类:化学高三上学期
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
下列说法正确的是:( )
A . 煤经过气化和液化等物理变化可转化为清洁燃料
B . 天然植物油常温下一般呈液态,有恒定的熔点、沸点
C . 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
D . 氯化钠是生活中常见的调味品和防腐剂
|
|
| 2. 单选题 | |
|
NA为阿伏加德罗常数,下列说法正确的是:( )
A . 标准状况下,11.2LH2O所含分子数大于0.5NA
B . 1mol淀粉水解后产生的葡萄糖分子数为NA
C . 1LpH=12的氢氧化钡溶液中OH-的数目为0.02NA
D . 15gCH3+(碳正离子)中含有电子数为10NA
|
|
| 3. 单选题 | |
|
下列叙述错误的是( )
A . 蔗糖水解生成的两种有机物互为同分异构体
B . 含有5个碳原子的饱和链烃,其一氯代物有3种
C . 乙烷与氯气在光照下发生反应的产物可能有10种
D . 金刚烷的结构为
|
|
| 4. 单选题 | ||||||||||||||||
|
下列实验操作、实验现象及目的均正确的是:( )
A . A
B . B
C . C
D . D
|
||||||||||||||||
| 5. 单选题 | |
|
短周期主族元素W、X、Y、Z的原子序数依次增大,Wˉ与X+电子层结构相同,Y所在周期数与族序数相同,Z的最高价氧化物的水化物为强酸。下列说法正确的是:( )
A . 简单离子半径:X>Y>Z>W
B . W、Z对应氢化物的沸点:W>Z
C . 周期表中Z的氧化物对应水化物的酸性最强
D . 工业上用电解XZ的水溶液制备X单质
|
|
| 6. 单选题 | |
|
有一种节能的氯碱工业新工艺,将电解池与燃料电池相组合,相关流程如下图所示(电极未标出),下列说法错误的是:( )
A . 电解池的阴极反应式2H20+2e-=H2↑+20H-
B . 相同条件下,当电解池生成2LCl2 , 理论上燃料电池应消耗1LO2
C . 电解池中阳离子移动流向阴极池
D . 溶液a、b、c的pH大小顺序为:a>b>c
|
|
| 7. 单选题 | |
|
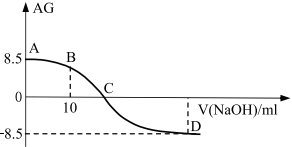
化学上常用AG表示溶液中的酸碱度,AG=
 。25℃时,用0.100mol/L的NaOH溶液滴定20.00m 0.100mol/L的醋酸溶液,AG与所加NaOH溶液的体积(V)关系如图所示,下列说法错误的是:( ) 。25℃时,用0.100mol/L的NaOH溶液滴定20.00m 0.100mol/L的醋酸溶液,AG与所加NaOH溶液的体积(V)关系如图所示,下列说法错误的是:( )
A . 点C时溶液存在c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
B . 点B时溶液存在2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
C . 25℃时,醋酸的水解常数Kh=10-4.5
D . 点D溶液的pH=11.25
|
|
| 8. 实验探究题 | |||||||||||||
|
印刷电路板是由有机复合材料和铜箔复合构成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,研究其制备及性质是一个重要的课题。
|
|||||||||||||
| 9. 综合题 | |
|
无机研究开创绝不无“钴”的时代,例如:CoCl2·6H2O是一种饲料营养强化剂、草酸钴可用于指示剂和催化剂。其中草酸钴的制备可用水钴矿(主要成分为Co2O3 , 含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)制取CoC2O4·2H2O工艺流程如下图所示:
已知: ①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等; ②酸性条件下,ClO3-不会氧化Co2+ , ClO3-转化为Cl-;
|
|
| 10. 综合题 | |
|
二甲醚制备两种方法原理如下
第一种方法:丹麦Topspe工艺的合成气一步法,是专门针对天然气原料开发的一项新技术。 ①2CH4(g)+O2(g) 第二种方法:二甲醚生产二步法,即先合成甲醇,甲醇在催化剂下制二甲醚。 ②CO(g)+2H2(g) ③2CH3OH(g)
|
|
- 广西壮族自治区北海市2019-2020学年高二下学期化学期末考试试卷
- 上海市徐汇区2018-2019学年高考化学二模考试试卷
- 2016-2017学年吉林省延边州汪清六中高一上学期期中化学试卷
- 2017年高考化学备考复习专题十六:有机合成与推断
- 2017年广西南宁市高考化学一模试卷
- 2016年四川省遂宁市高考化学二诊试卷
- 高中化学鲁科版(2019)必修第二册 第1章测试卷
- 吉林省汪清县第六中学2019-2020学年高一上学期化学期中考试试卷
- 山西省长治市2018-2019学年高一下学期理科综合(化学)3月月考试卷
- 高中化学人教版(2019)必修第一册第一章第三节 氧化还原反应
- 2016-2017学年山东省淄博市淄川一中高二下学期期中化学试卷
- 云南省昭通市水富县云天化中学2016-2017学年高二上学期化学期末考试试卷(理科)




 CH3OCH3(g)+H2O(g) △H1
CH3OCH3(g)+H2O(g) △H1



