2020年高考理综化学真题试卷(新课标II)
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
北宋沈括《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧。挹其水熬之则成胆矾,烹胆矾则成铜。熬胆矾铁釜,久之亦化为铜”。下列有关叙述错误的是( )
A . 胆矾的化学式为CuSO4
B . 胆矾可作为湿法冶铜的原料
C . “熬之则成胆矾”是浓缩结晶过程
D . “熬胆矾铁釜,久之亦化为铜”是发生了置换反应
|
|
| 2. 单选题 | |
|
某白色固体混合物由NaCl、KCl、MgSO4、CaCO3中的两种组成,进行如下实验:① 混合物溶于水,得到澄清透明溶液;② 做焰色反应,通过钴玻璃可观察到紫色;③ 向溶液中加碱,产生白色沉淀。根据实验现象可判断其组成为( )
A . KCl、NaCl
B . KCl、MgSO4
C . KCl、CaCO3
D . MgSO4、NaCl
|
|
| 3. 单选题 | |
|
二氧化碳的过量排放可对海洋生物的生存环境造成很大影响,其原理如下图所示。下列叙述错误的是
A . 海水酸化能引起
 浓度增大、 浓度增大、  浓度减小
B . 海水酸化能促进CaCO3的溶解,导致珊瑚礁减少
C . CO2能引起海水酸化,其原理为 浓度减小
B . 海水酸化能促进CaCO3的溶解,导致珊瑚礁减少
C . CO2能引起海水酸化,其原理为   D . 使用太阳能、氢能等新能源可改善珊瑚的生存环境
D . 使用太阳能、氢能等新能源可改善珊瑚的生存环境
|
|
| 4. 单选题 | |
|
吡啶(
A . Mpy只有两种芳香同分异构体
B . Epy中所有原子共平面
C . Vpy是乙烯的同系物
D . 反应②的反应类型是消去反应
|
|
| 5. 单选题 | |
|
据文献报道:Fe(CO)5催化某反应的一种反应机理如下图所示。下列叙述错误的是( )
A . OH-参与了该催化循环
B . 该反应可产生清洁燃料H2
C . 该反应可消耗温室气体CO2
D . 该催化循环中Fe的成键数目发生变化
|
|
| 6. 单选题 | |
|
电致变色器件可智能调控太阳光透过率,从而实现节能。下图是某电致变色器件的示意图。当通电时,Ag+注入到无色WO3薄膜中,生成AgxWO3 , 器件呈现蓝色,对于该变化过程,下列叙述错误的是( )
A . Ag为阳极
B . Ag+由银电极向变色层迁移
C . W元素的化合价升高
D . 总反应为:WO3+xAg=AgxWO3
|
|
| 7. 单选题 | |
|
一种由短周期主族元素组成的化合物(如图所示),具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大、且总和为24。下列有关叙述错误的是( )
A . 该化合物中,W、X、Y之间均为共价键
B . Z的单质既能与水反应,也可与甲醇反应
C . Y的最高化合价氧化物的水化物为强酸
D . X的氟化物XF3中原子均为8电子稳定结构
|
|
| 8. 综合题 | |
|
化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
|
|
| 9. 综合题 | |||||||||||||||||||
|
苯甲酸可用作食品防腐剂。实验室可通过甲苯氧化制苯甲酸,其反应原理简示如下:
实验步骤:①在装有温度计、冷凝管和搅拌器的三颈烧瓶中加入1.5 mL甲苯、100 mL水和4.8 g(约0.03 mol)高锰酸钾,慢慢开启搅拌器,并加热回流至回流液不再出现油珠。 ②停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全。将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥。称量,粗产品为1.0 g。 ③纯度测定:称取0. 122 g粗产品,配成乙醇溶液,于100 mL容量瓶中定容。每次移取25. 00 mL溶液,用0.01000 mol·L−1的KOH标准溶液滴定,三次滴定平均消耗21. 50 mL的KOH标准溶液。 回答下列问题:
|
|||||||||||||||||||
| 10. 综合题 | |||||||||
|
天然气的主要成分为CH4 , 一般还含有C2H6等烃类,是重要的燃料和化工原料。
|
|||||||||
- 广东省潮州市潮安区颜锡祺中学2019-2020学年高二上学期化学期中考试试卷
- 第24讲:烃
- 人教版化学高二选修4第四章第一节原电池同步练习
- 云南省大理州巍山县第一中学2019-2020学年高一上学期化学期末考试试卷
- 甘肃省天水市第三中学2016-2017学年高二上学期化学开学考试试卷
- 2016-2017学年河南省洛阳市回民中学高二上学期开学化学试卷
- 2016-2017学年江苏省无锡市高一上学期期末化学试卷
- 2017年四川省遂宁市高考化学零珍试卷
- 山东省临沂市罗庄区2018-2019学年高二上学期化学1月月考试卷
- 辽宁省大连市2017-2018学年高一下学期化学期末考试试卷(理)
- 陕西省西安市莲湖区2019-2020学年高一下学期化学期末考试试卷
- 上海中学2016-2017学年高一上学期化学期末考试试卷






 ,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为。
,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为。
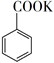 + MnO2
+ MnO2 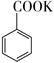 +HCl→
+HCl→ 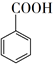 +KCl
+KCl C2H6+H2。反应在初期阶段的速率方程为:r=k×
C2H6+H2。反应在初期阶段的速率方程为:r=k×  ,其中k为反应速率常数。
,其中k为反应速率常数。




