广东省东莞市2017-2018学年高三理综-化学第二次模拟考试试卷
广东省东莞市2017-2018学年高三理综-化学第二次模拟考试试卷
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
化学与生活紧密相关。下列做法错误的是( )
A . 在家可用食醋代替CO2来增强漂白粉的漂白性
B . 用食用碱去除燃气灶的油污
C . 为提高粮食产量,大量使用农药
D . 处理秸秆的方法之一,将秸杆转化为乙醇以作汽车燃料
|
|
| 2. 单选题 | |
|
设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A . 标准状况下,22.4L的H2和22.4L的F2混合后,气体分子数为2NA
B . 0.3mol二氧化氮与水反应转移电子数为0.2NA
C . 1L2mol·L-1的 NaHCO3溶液中所含H原子数为2NA
D . 0.1mol的NO与足量O2的混合物中含有的N原子数为0.2NA
|
|
| 3. 单选题 | |
|
有机物M(
A . 5种
B . 6种
C . 7种
D . 8种
|
|
| 4. 单选题 | |
|
实验室用下列装置制备无水AlCl3(183℃升华),无水AlCl3遇潮湿空气即产生大量白雾。下列说法错误的是( )
A . b、c、f中依次盛装饱和食盐水、浓硫酸、浓硫酸
B . g中发生的反应为Cl2+2NaOH=NaCl+NaClO+H2O
C . e装置的收集器必须保持干燥
D . 实验时,a和d处酒精灯应同时点燃
|
|
| 5. 单选题 | |
|
近年来,我国多条高压直流电线路的瓷绝缘子出现铁帽腐蚀现象,在铁帽上加锌环能有效防止铁帽的腐蚀,下列说法正确的是( )
A . 阴极电极反应为4OHˉ-4eˉ=O2↑+2H2O
B . 阳极电极反应为Zn-2eˉ=Zn2+
C . 该装置为牺牲阳极的阴极保护法
D . 绝缘子表面产生的OH-向阴极移动
|
|
| 6. 单选题 | |
|
X、Y、Z、W是短周期主族元素。已知Z是地壳中含量第二位的元素,W在短周期主族元素中原子半径最大,Z、X、Y在元素周期表中的相对位置如图所示。下列说法正确的是( )
A . Z的氧化物属于酸性氧化物,能与水反应生成相应的酸
B . W2Y和W2Y2中阴、阳离子的个数比相同,化学键类型不完全相同
C . X、Y与氢三种元素形成的物质中一定不含离子键
D . X和Y只能形成一种物质
|
|
| 7. 单选题 | |
|
常温下,下列有关电解质溶液的说法正确的是( )
A . 0.1mol·L-1CH3CONH4溶液的pH=7,则c(NH4+)=c(CH3COOˉ)
B . 25℃时,pH为6的碳酸溶液中水电离出的c(H+)=1.0×10-6mol·L-1
C . pH=12的Ba(OH)2溶液与pH=2的盐酸等体积混合,溶液呈碱性
D . 0.1mol·L-1醋酸与0.2mol·L-1 Na2 CO3溶液等体积混合:4c(CH3COOH)+4c(CH3COOˉ)=3c(Na+)
|
|
| 8. 实验探究题 | |
|
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解,易水解,可用作肥料、灭火剂、洗涤剂等。实验室制备氨基甲酸铵的反应如下:2NH3(g)+CO2(g)
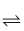 NH2 COONH4(s) △H<0,该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则水解生成碳酸铵或碳酸氢铵。某化学兴趣小组按下图装置进行如下实验: NH2 COONH4(s) △H<0,该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则水解生成碳酸铵或碳酸氢铵。某化学兴趣小组按下图装置进行如下实验:
步骤1:按图连接好实验装置,……………………….。 步骤2:在相应仪器中装入药品,其中1在三颈烧瓶中加入足量的氢氧化钠固体,在恒压滴液漏斗中装入浓氨水。 步骤3:滴加浓氨水并搅拌,调节反应速率,在反应器中得到产品。 …… 请回答下列问题:
|
|
| 9. 实验探究题 | |||||||||||||||||||||||||||||||
|
利用工业炼铅产生的锌灰(主要成分为ZnO、PbO、FeO、MnO2、CuO)可回收制备ZnCl2 , 工艺流程如下:
回答下列问题
|
|||||||||||||||||||||||||||||||
| 10. 综合题 | |
|
近年来,磁性材料的研究备受国际磁学界的关注。Fe3O4具有许多优异的性能,在磁性材料等领域应用广泛。回答下列问题:
|
|
高中化学 试卷推荐
- 上海中学2016-2017学年高一上学期化学期末考试试卷
- 2017年天津市南开区高考化学模拟试卷
- 浙江省慈溪市六校2018-2019学年高二上学期化学期中考试试卷
- 2018年4月浙江省普通高校招生选考科目考试化学试卷
- 2015-2016学年山东省枣庄市滕州十一中高三上学期期末化学模拟试卷(三)
- 安徽省皖南八校2019-2020学年高三上学期化学第二次月考试卷
- 2015-2016学年湖北省武汉市华中师大一附中高三上学期期中化学试卷
- 人教高中化学一轮复习:专题5 金属Na、Fe以及其化合物
- 陕西省榆林市第二中学2018-2019学年高二下学期化学期中考试试卷
- 2018年高考理综化学真题试卷(全国Ⅲ卷)
- 天津市红桥区2017-2018学年高一上学期化学期末考试试卷
- 专题18:化学反应与能量变化
最近更新







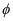 (CO2)~t曲线如图所示,温度T1、T2、T3由大到小的关系是,判断依据是。
(CO2)~t曲线如图所示,温度T1、T2、T3由大到小的关系是,判断依据是。



