内蒙古包头市2022届高三第二次模拟考试理综试卷化学试题
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | ||||||||||||||||
|
化学创造美好生活,下列生活实践活动与对应化学知识关联错误的是( )
A . A
B . B
C . C
D . D
|
||||||||||||||||
| 2. 单选题 | |
|
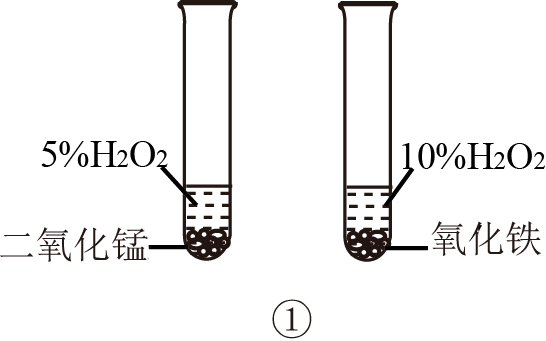
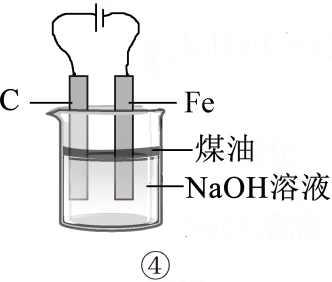
下列操作或装置正确并能达到实验目的的是( )
A . 图①用于比较二氧化锰和氧化铁的催化效果
B . 图②用此装置可制CaCO3沉淀
C . 图③用于检验铜与浓硫酸反应后的混合液中是否含有Cu2+
D . 图④用于制备Fe(OH)2沉淀
|
|
| 3. 单选题 | |
|
在含有大量漂粉精的溶液中,下列有关叙述正确的是( )
A . 加入K+、
 、 、 、I-等离子,可以大量共存。
B . 可用pH试纸测定该溶液的pH
C . 向该溶液中滴加少量 、I-等离子,可以大量共存。
B . 可用pH试纸测定该溶液的pH
C . 向该溶液中滴加少量 溶液,反应的离子方程式为: 溶液,反应的离子方程式为: D . 该溶液中滴入一定量的浓盐酸,每产生
D . 该溶液中滴入一定量的浓盐酸,每产生 , 转移电子数约为 , 转移电子数约为 个 个
|
|
| 4. 单选题 | |
|
布洛芬(异丁苯丙酸)有镇痛、抗炎作用,结构如图所示,下列说法正确的是( )
A . 异丁苯丙酸是苯的同系物
B . 分子式为
 C . 苯环上二氯代物有3种
D . 1mol该分子最多可与
C . 苯环上二氯代物有3种
D . 1mol该分子最多可与 加成 加成
|
|
| 5. 单选题 | |
|
W、X、Y、Z为原子序数依次增大的短周期主族元素,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的化合物的水溶液呈中性。下列说法正确的是( )
A . W与X形成的化合物溶于水后溶液呈碱性
B . 简单离子半径:W<X<Z
C . 简单气态氢化物熔沸点:W<Y
D . 最高价氧化物对应水化物的酸性:Y>Z
|
|
| 6. 单选题 | |
|
甲池是一种常见的氢氧燃料电池,如下图所示。一段时间乙池内,从D口通入10mol混合气体,其中含苯的物质的量分数为20%(杂质不参与反应),C出来的气体中含苯的物质的量分数为10%的混合气体(不含H2 , 该条件下苯、环己烷都为气态),下列说法正确的是( )
A . 甲池中A处为负极,通入H2
B . 乙池中多孔性惰性电极上发生:
|
|
| 7. 单选题 | |
|
25℃时,在
 的 的 溶液中,通入 溶液中,通入 气体或加入 气体或加入 固体以调节溶液 固体以调节溶液 , 溶液的 , 溶液的 与 与 关系如图所示(忽略溶液体积的变化、 关系如图所示(忽略溶液体积的变化、 的挥发)。已知: 的挥发)。已知: 。下列说法正确的是( ) 。下列说法正确的是( )
A .
 的电离方程式为: 的电离方程式为: B . 当
B . 当 时,溶液中 时,溶液中 C . 在
C . 在 溶液中含 溶液中含 为 为 , 当调溶液 , 当调溶液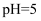 时, 时, 开始沉淀
D . 当加入 开始沉淀
D . 当加入 调溶液 调溶液 时,溶液中离子 时,溶液中离子
|
|
| 8. 综合题 | ||||||||||||||||||||||||||||||||||
|
锂离子电池是新能源汽车的核心部件,综合利用好含锂资源对新能源汽车可持续发展至关重要。科学家用含锂废渣(主要金属元素的含量:
 、 、 、 、 、 、 )制备 )制备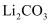 , 并制备锂离子电池的正极材料 , 并制备锂离子电池的正极材料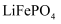 。部分工艺流程如下: 。部分工艺流程如下:
资料:①滤液1、滤液2中部分离子浓度(
②EDTA能和某些二价金属离子形成稳定的水溶性络合物 ③某些物质的溶解度(S)
|
||||||||||||||||||||||||||||||||||
| 9. 实验探究题 | ||||||||||||||||||
|
二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶的低温硫化剂和粘结剂。查阅资料可知S2Cl2具有下列性质:
|
||||||||||||||||||
| 10. 综合题 | |
|
中国科研团队利用低温等离子体协同催化技术,在常温常压下实现了将甲烷和二氧化碳一步转化为具有高附加值的液体燃料和化工产品。回答下列问题:
|
|






 )
)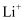
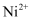






 溶液,控制温度在95℃充分反应后,分离出固体
溶液,控制温度在95℃充分反应后,分离出固体 稀溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极进行电解。电解后,向得到的
稀溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极进行电解。电解后,向得到的 溶液共热、过滤、洗涤、干燥得高纯
溶液共热、过滤、洗涤、干燥得高纯 , 则放电时正极反应式为。
, 则放电时正极反应式为。

 反应制得S2Cl2粗品。
反应制得S2Cl2粗品。
 溶液,过滤。
溶液,过滤。 溶液,过滤、洗涤、干燥,称得固体质量为2.87g。
溶液,过滤、洗涤、干燥,称得固体质量为2.87g。 分别为
分别为 、
、 , 试写出甲烷与CO2合成乙酸的热化学方程式。
, 试写出甲烷与CO2合成乙酸的热化学方程式。

 、
、 , 加入
, 加入 催化剂并加热至
催化剂并加热至 使其发生反应:
使其发生反应: 。
。
 , 某时刻测得
, 某时刻测得 , 则
, 则
 ,
, 
 。
。 倍,则该反应用分压表示的平衡常数
倍,则该反应用分压表示的平衡常数
 (计算结果保留三位有效数字)。
(计算结果保留三位有效数字)。


