2017年广东省茂名市高考化学一模试卷
2017年广东省茂名市高考化学一模试卷
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-09-01
授权方式:免费下载
下载地址:点此下载
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-09-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
下列有关说法正确的是( )
A . 氮氧化合物、PM 2.5颗粒、CO2都会导致酸雨
B . 氯水和二氧化硫混合使用能增强漂白效果
C . 硫酸铜溶液可用于泳池消毒是利用了Cu2+能使蛋白质盐析
D . 轮船上挂锌锭防止铁腐蚀属于牺牲阳极的阴极保护法
|
|
| 2. 单选题 | |
|
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A . 20 g D2O 含有的质子数为10NA
B . 1mol Na2O2与足量水反应转移的电子数为NA , 生成的气体在标况下的体积为22.4L
C . 1L 0.1mol/L HF溶液中含有共价键数目为0.1 NA
D . NA个Fe(OH)3胶体粒子的质量为107g
|
|
| 3. 单选题 | |
|
下列实验操作能达到实验目的是( )
A . 用排饱和氯化铵溶液的方法收集氨气
B . 用重结晶的方法除去BaSO4固体中混有的NaCl
C . 将碳酸钙置于蒸发皿中高温灼烧可得到氧化钙
D . 将硫酸铜溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到胆矾晶体
|
|
| 4. 单选题 | |
|
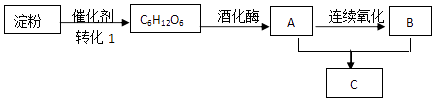
一些常见有机物的转化如图下列说法正确的是( )
A . 上述有机物中只有C6H12O6属于糖类物质
B . 转化1可在人体内完成,该催化剂属于蛋白质
C . 物质C和油脂类物质互为同系物
D . 物质A和B都属于电解质
|
|
| 5. 单选题 | |
|
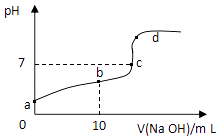
已知草酸H2C2O4是二元弱酸.室温下向10mL 0.01mol•L﹣1 H2C2O4溶液中逐滴加入0.01mol•L﹣1NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )
A . a点pH>2
B . b点表示的溶液中c(C2O42﹣)>c(H2C2O4)
C . c点时加入NaOH溶液的体积为20mL
D . d点存在c(Na+)+c(H+)=c(OH﹣)+2c(C2O42﹣)+c(HC2O4﹣)
|
|
| 6. 单选题 | |
|
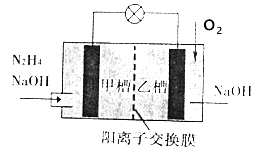
肼(N2H4)暴露在空气中容易爆炸,但利用其作燃料电池是一种理想的电池,具有容量大、能量转化率高、产物无污染灯特点,其工作原理如图所示,下列叙述正确的是( )
A . 电池工作时,正极附近的pH降低
B . 当消耗1molO2时,有2molNa+由甲槽向乙槽迁移
C . 负极反应为4OH﹣+N2H4﹣4e﹣=N2↑+4H2O
D . 若去掉离子交换膜电池也能正常工作
|
|
| 7. 单选题 | |
|
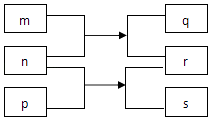
短周期主族元素X、Y、Z、W、R原子序数依次增大.m、p、r是这些元素组成的二元化合物,n、q、s是这些元素组成的三元化合物且属于离子化合物,其中s的水溶液俗称水玻璃,0.1mol/L n溶液的pH为13,m可制作耐火管且属于两性物质.上述物质的转化关系如图所示.下列说法正确的是( )
A . 离子半径大小:Y>Z>W
B . 简单气态氢化物的稳定性:R>Y
C . W的最高价氧化物对应的水化物碱性比Z的强
D . 单质熔点:Z>R>X
|
|
| 8. 实验探究题 | |||||||||||||
|
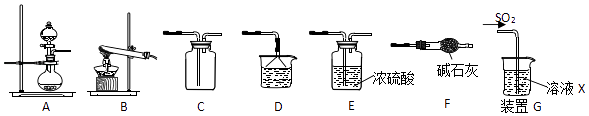
某研究性学习小组通过下列反应原理制备SO2并进行性质探究.反应原理为:Na2SO3(固)+H2SO4(浓)=Na2SO4+SO2↑+H2O
|
|||||||||||||
| 9. 综合题 | |
|
甲烷重整可以获得CO、H2等重要化工原料,相关反应原理如下:
①CH4(g)+ ②CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H=+206kJ/mol ③CH4(g)+CO2(g)⇌2CO(g)+2H2(g)△H=+247kJ/mol副反应 ④CH4(g)+2O2(g)⇌CO2(g)+2H2O (g)△H=﹣889.6kJ/mol
|
|
| 10. 综合题 | |
|
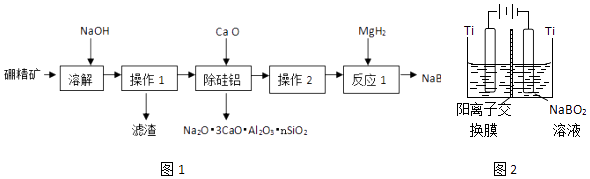
硼氢化钠(NaBH4)具有优良的还原性,在有机化学和无机化学领域有着广泛的应用.利用硼精矿(主要成分为B2O3 , 含有少量Al2O3、SiO2、FeCl3等)制取NaBH4的流程如图1:
已知:偏硼酸钠(NaBO2)易溶于水,不溶于醇,在碱性条件下稳定存在,回答下列问题:
|
|
高中化学 试卷推荐
- 备考2018年高考化学一轮基础复习:专题10 卤素及其化合物
- 2015-2016学年山西省朔州市右玉一中高二下学期期中化学试卷
- 高中化学人教版(2019)选择性必修1 第一章第一节 反应热
- 2018年高考化学真题分类汇编专题13:化学实验方案的设计与评价
- 2016-2017学年浙江省温州市十五校联合体高一下学期期中化学试卷
- 上海市杨浦区2020年高考化学二模试卷
- 专题03:离子反应
- 贵州省黔南州2019-2020学年高二下学期化学期末考试试卷
- 广东省佛山市顺德区2018-2019学年高一下学期化学期末考试试卷
- 河南省郑州市2019-2020学年高二下学期化学期末考试试卷
- 2017年浙江省嘉兴市高考化学模拟试卷
- 高中化学人教版(2019)选择性必修1第四章实验活动5制作简单的燃料电池
最近更新
 O2(g)⇌CO(g)+2H2(g)△H=﹣36kJ/mol
O2(g)⇌CO(g)+2H2(g)△H=﹣36kJ/mol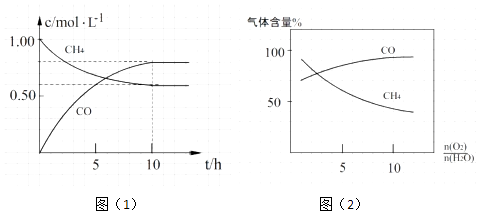
 增大而增大,其主要原因是.
增大而增大,其主要原因是.