初中化学人教版一轮复习考点11盐和化肥
初中化学人教版一轮复习考点11盐和化肥
教材版本:化学
试卷分类:化学中考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
教材版本:化学
试卷分类:化学中考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 计算题 | |
|
现有
H2SO4与CuSO4的混合溶液,为了分析混合溶液中H2SO4与CuSO4的质量分数,设计了如图实验方案:(注:硫酸铜溶液略显酸性)
|
|
| 2. 填空题 | |
|
化学与我们的生活息息相关。请按要求回答下列问题。
|
|
| 3. 单选题 | |
|
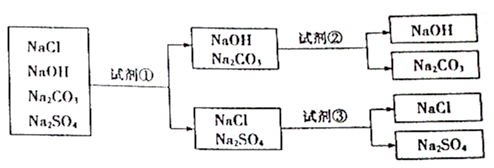
为鉴别氯化钠、氢氧化钠、碳酸钠和硫酸钠四种物质的溶液,设计如下实验:
下面对试剂①、试剂②和试剂③的选择,合理的是( )
A . ①酚酞②稀盐酸③氯化钡
B . ①酚酞②稀盐酸③稀盐酸
C . ①石蕊②氯化钡③稀盐酸
D . ①石蕊②氯化钡③碳酸钠
|
|
| 4. 填空题 | |
|
家庭或企业加工馒头、面包和饼干等食品时,常在面粉中加入膨松剂(如碳酸氢钠),蒸制或烘焙食品中产生大量气体,使面团疏松、多孔,制作的食品松软或酥脆,易于消化吸收。阅读上面信息后,回答:
|
|
| 5. 单选题 | |
|
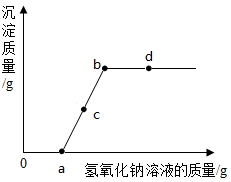
向一定量的硫酸铜和稀硫酸的混合溶液中滴加氢氧化钠溶液,反应过程中产生的沉淀质量与加入的氢氧化钠溶液质量关系如图所示。下列说法错误的是( )
A . a点溶液中的溶质有2种
B . c点溶液中的溶质有3种
C . ab(不包括a点)段有沉淀生成
D . d点溶液的pH>7
|
|
| 6. 单选题 | |
|
一定温度下,向a g FeCl3溶液中加入NaOH固体,溶液的质量与加入NaOH固体的质量变化关系如下图所示。下列叙述错误的是( )
A . Fe(OH)3沉淀完全时消耗NaOH的质量为ng
B . P点对应的溶液中 NaOH达到饱和状态
C . m=c-a
D . 生成Fe(OH)3的质量为(n-b+a)g
|
|
| 7. 单选题 | |
|
现有一包固体粉末,可能是由CaCO3、Na2CO3、Na2SO4、NaCl、Ba(NO3)2中的一种或几种组成。为确定其成分,进行下列实验(微溶物质按可溶处理)。
①取少量固体粉末于试管中,加足量的水溶解,静置后得到白色沉淀A和无色溶液B; ②过滤,将白色沉淀A放入试管中,滴加过量的稀硝酸,有气泡产生,沉淀部分溶解; ③取无色溶液B少许于试管中,滴加过量的稀硝酸,有气泡产生,得到溶液C; ④在溶液C中滴加硝酸银溶液,有白色沉淀产生。 以下说法正确的是( )
A . 白色沉淀A的成分是BaSO4和CaCO3
B . 该固体粉末中乙一定有CaCO3、Na2SO4、Na2CO3和Ba(NO3)2
C . 无色溶液B中的溶质一定有NaNO3、Na2CO3和NaCl
D . 该固体粉末中一定有Na2SO4、Ba(NO3)2和Na2CO3 , 可能有CaCO3和NaCl
|
|
| 8. 单选题 | ||||||||||||||||
|
向甲物质中逐滴加入X溶液至过量,生成沉淀或气体的质量与加入X溶液的质量关系不符合下图的是( )
A . A
B . B
C . C
D . D
|
||||||||||||||||
| 9. 实验探究题 | |||||||||||
|
某化学兴趣小组的同学对酸、碱和盐的性质进行探究,请你参与。
[查阅资料] 20℃时,部分物质的溶解度。
|
|||||||||||
| 10. 单选题 | |
|
下列物质既可以做治疗胃酸的胃药,又可以做面点发酵剂的是( )
A . NaCl
B . NaOH
C . NaHCO3
D . Na2SO4
|
|
初中化学 试卷推荐
- 内蒙古赤峰市2019年中考化学试卷
- 江西省南昌市东湖区南昌28中教育集团2019-2020学年九年级下学期化学4月月考试卷
- 天津市红桥区2019年中考化学一模试卷
- 河北省邯郸市武安市2019-2020学年九年级上学期化学期末考试试卷
- 重庆市南区学校2017-2018学年中考化学模拟考试试卷
- 安徽省滁州市凤阳县、定远县、明光市2017-2018学年九年级上学期化学期末考试试卷
- 上海市嘉定区嘉一联中2018-2019学年九年级上学期化学期中考试试卷
- 安徽省合肥市“十校”大联考2015-2016学年中考化学模拟考试试卷(一)
- 黑龙江省鸡西十九中2016-2017学年九年级上学期化学期中考试试卷
- 湖南省张家界市永定区2017-2018学年中考化学一模考试试卷
- 江苏省东台市第一教育联盟2016-2017学年九年级下学期化学第一次月考考试试卷
- 福建省莆田市2015-2016学年中考化学模拟考试试卷(5月份)
最近更新