四川省广元市2021年高考化学三模试卷
四川省广元市2021年高考化学三模试卷
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
X、Y、Z、W、M为短周期主族元素,25℃时,其最高价氧化物对应水化物的溶液浓度均为0.01mol·L-1的pH和原子半径大小的关系如下图所示。下列有关说法错误的是( )
A . M元素一定位于第三周期第IA族
B . X与Z的简单气态氢化物反应生成的化合物中含有离子键和极性键
C . Z、W的气态氢化物的热稳定性:Z<W
D . W的氧化物可能具有还原性、氧化性
|
|
| 2. 单选题 | |
|
中华传统文化与化学紧密相关,下列有关说法正确的是( )
A . “自古书契多编以竹简,其用缣帛(丝织品)者谓之为纸”,纸的主要成分为蛋白质
B . 李白有诗云“日照香炉生紫烟”,这是描写碘的升华
C . “司南之杓(勺),投之于地,其柢(勺柄)指南”中的“杓”含磁性物质Fe2O3
D . 柴窑烧制出的“明如镜,薄如纸,声如馨”的瓷器,其主要原料为二氧化硅
|
|
| 3. 单选题 | |
|
有机物合成对于人类的健康、丰富人类的物质生活和社会经济的发展有着十分重要的作用。某有机物的结构简式如图。下列说法正确的是( )
A . 能与NaHCO3溶液反应
B . 1mol该有机物最多能与3molH2反应
C . 能发生消去反应生成碳碳双键
D . 不能使溴水褪色
|
|
| 4. 单选题 | |
|
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A . 1mol乙醇分子中含C—H键的数目为6NA
B . 标准状况下,22.4L的12C18O中含有中子的数目为16NA
C . 密闭容器中1molPCl3与1molCl2反应制备PCl5(g),增加了2NA个P—Cl键
D . 常温下,1L0.1mol·L-1的醋酸溶液中H+数目为0.1NA
|
|
| 5. 单选题 | |||||||||||||||||||||
|
对下列反应的推断或解释正确的是( )
A . A
B . B
C . C
D . D
|
|||||||||||||||||||||
| 6. 单选题 | |
|
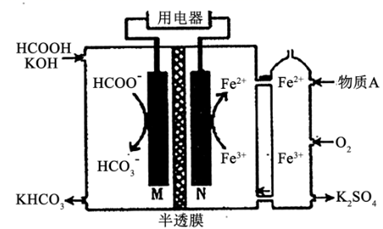
HCOOH燃料电池的装置如图所示,M、N表示电极,两电极区间用允许K+、H+通过的半透膜隔开。下列说法正确的是( )
A . M电极反应式为:HCOO-+2OH--2e-=HCO
 +H2O
B . 在电池工作时,每生成1molHCO +H2O
B . 在电池工作时,每生成1molHCO  ,将会有1molK+通过半透膜移向右侧
C . 图中所示需要补充的A物质为KOH
D . 电子的流动方向为:N→用电器→M ,将会有1molK+通过半透膜移向右侧
C . 图中所示需要补充的A物质为KOH
D . 电子的流动方向为:N→用电器→M
|
|
| 7. 单选题 | |
|
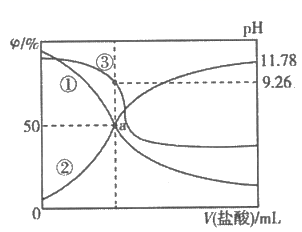
常温下,用0.2mol·L-1盐酸滴定25.00mL0.2mol·L-1NH3·H2O溶液,所得溶液pH、NH
 和NH3·H2O的物质的量分数与滴加盐酸体积的关系如图所示。下列叙述正确的是( ) 和NH3·H2O的物质的量分数与滴加盐酸体积的关系如图所示。下列叙述正确的是( )
A . 曲线①代表φ(NH
 ),曲线②代表φ(NH3·H2O)
B . a点溶液中存在c(Cl-)>c(NH ),曲线②代表φ(NH3·H2O)
B . a点溶液中存在c(Cl-)>c(NH  )=c(NH3·H2O)
C . NH3·H2O的电离常数的数量级为10-4
D . 应选用甲基橙为指示剂,滴定终点溶液的颜色变化为黄色变为红色 )=c(NH3·H2O)
C . NH3·H2O的电离常数的数量级为10-4
D . 应选用甲基橙为指示剂,滴定终点溶液的颜色变化为黄色变为红色
|
|
| 8. 实验探究题 | ||||||||||||||||
|
亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水剧烈水解生成氮的两种氧化物与氯化氢,易溶于浓硫酸。常可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。其制备装置如图所示(已知:NO+NO2+2NaOH=2NaNO2+H2O):
|
||||||||||||||||
| 9. 综合题 | |
|
合理利用工厂烟灰,变废为宝,对保护环境具有重要意义。以某钢铁厂烟灰(主要成分为ZnO,并含少量的CuO、MnO2、Fe2O3等)为原料制备氧化锌的工艺流程如图:
|
|
| 10. 综合题 | |||||||||||||||||
|
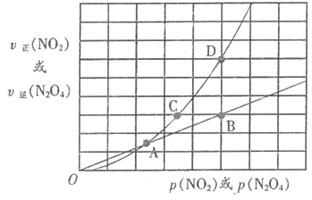
氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理和化学平衡对于消除环境污染有重要意义。
|
|||||||||||||||||
最近更新




 的浓度是5.0×10-3mol/L,此时溶液中Cl-浓度是。
的浓度是5.0×10-3mol/L,此时溶液中Cl-浓度是。 回答下列问题:
回答下列问题: 2NO2(g)ΔH。上述反应分两步完成,其反应历程如图所示。
2NO2(g)ΔH。上述反应分两步完成,其反应历程如图所示。