2019е№ҙй«ҳиҖғзҗҶз»јеҢ–еӯҰзңҹйўҳиҜ•еҚ·пјҲеӨ©жҙҘеҚ·пјү
ж•ҷжқҗзүҲжң¬пјҡеҢ–еӯҰ
иҜ•еҚ·еҲҶзұ»пјҡеҢ–еӯҰй«ҳиҖғ
иҜ•еҚ·еӨ§е°Ҹпјҡ1.0 MB
ж–Ү件зұ»еһӢпјҡ.doc жҲ– .pdf жҲ– .zip
еҸ‘еёғж—¶й—ҙпјҡ2024-05-01
жҺҲжқғж–№ејҸпјҡе…Қиҙ№дёӢиҪҪ
дёӢиҪҪең°еқҖпјҡзӮ№жӯӨдёӢиҪҪ
д»ҘдёӢдёәиҜ•еҚ·йғЁеҲҶиҜ•йўҳйў„и§Ҳ
| 1. еҚ•йҖүйўҳ | |
|
еҢ–еӯҰеңЁдәәзұ»зӨҫдјҡеҸ‘еұ•дёӯеҸ‘жҢҘзқҖйҮҚиҰҒдҪңз”ЁпјҢдёӢеҲ—дәӢе®һдёҚж¶үеҸҠеҢ–еӯҰеҸҚеә”зҡ„жҳҜпјҲ пјү
A . еҲ©з”Ёеәҹејғзҡ„з§ёз§Ҷз”ҹдә§з”ҹзү©иҙЁзҮғж–ҷд№ҷйҶҮ
B . еҲ©з”ЁзҹіжІ№з”ҹдә§еЎ‘ж–ҷгҖҒеҢ–зәӨзӯүй«ҳеҲҶеӯҗжқҗж–ҷ
C . еҲ©з”Ёеҹәжң¬зҡ„еҢ–еӯҰеҺҹж–ҷз”ҹдә§еҢ–еӯҰеҗҲжҲҗиҚҜзү©
D . еҲ©з”ЁеҸҚжё—йҖҸиҶңд»Һжө·ж°ҙдёӯеҲҶзҰ»еҮәж·Ўж°ҙ
|
|
| 2. еҚ•йҖүйўҳ | ||||||||||||||||
|
дёӢеҲ—зҰ»еӯҗж–№зЁӢејҸиғҪз”ЁжқҘи§ЈйҮҠзӣёеә”е®һйӘҢзҺ°иұЎзҡ„жҳҜпјҲ пјү
A . A
B . B
C . C
D . D
|
||||||||||||||||
| 3. еҚ•йҖүйўҳ | |
|
дёӢеҲ—жңүе…ійҮ‘еұһеҸҠе…¶еҢ–еҗҲзү©зҡ„дёҚеҗҲзҗҶзҡ„жҳҜпјҲ пјү
A . е°Ҷеәҹй“Ғеұ‘еҠ е…Ҙ
 жә¶ж¶ІдёӯпјҢеҸҜз”ЁдәҺйҷӨеҺ»е·Ҙдёҡеәҹж°”дёӯзҡ„ жә¶ж¶ІдёӯпјҢеҸҜз”ЁдәҺйҷӨеҺ»е·Ҙдёҡеәҹж°”дёӯзҡ„  B . й“қдёӯж·»еҠ йҖӮйҮҸй’ҫпјҢеҲ¶еҫ—дҪҺеҜҶеәҰгҖҒй«ҳејәеәҰзҡ„й“қеҗҲйҮ‘пјҢеҸҜз”ЁдәҺиҲӘз©әе·Ҙдёҡ
C . зӣҗзўұең°пјҲеҗ«иҫғеӨҡ
B . й“қдёӯж·»еҠ йҖӮйҮҸй’ҫпјҢеҲ¶еҫ—дҪҺеҜҶеәҰгҖҒй«ҳејәеәҰзҡ„й“қеҗҲйҮ‘пјҢеҸҜз”ЁдәҺиҲӘз©әе·Ҙдёҡ
C . зӣҗзўұең°пјҲеҗ«иҫғеӨҡ  зӯүпјүдёҚеҲ©дәҺдҪңзү©з”ҹй•ҝпјҢеҸҜж–ҪеҠ зҶҹзҹізҒ°иҝӣиЎҢж”№иүҜ
D . ж— ж°ҙ зӯүпјүдёҚеҲ©дәҺдҪңзү©з”ҹй•ҝпјҢеҸҜж–ҪеҠ зҶҹзҹізҒ°иҝӣиЎҢж”№иүҜ
D . ж— ж°ҙ  е‘Ҳи“қиүІпјҢеҗёж°ҙдјҡеҸҳдёәзІүзәўиүІпјҢеҸҜз”ЁдәҺеҲӨж–ӯеҸҳиүІзЎ…иғ¶жҳҜеҗҰеҗёж°ҙ е‘Ҳи“қиүІпјҢеҗёж°ҙдјҡеҸҳдёәзІүзәўиүІпјҢеҸҜз”ЁдәҺеҲӨж–ӯеҸҳиүІзЎ…иғ¶жҳҜеҗҰеҗёж°ҙ
|
|
| 4. еҚ•йҖүйўҳ | |||||||||||||
|
дёӢеҲ—е®һйӘҢж“ҚдҪңжҲ–иЈ…зҪ®иғҪиҫҫеҲ°зӣ®зҡ„зҡ„жҳҜпјҲ пјү
A . A
B . B
C . C
D . D
|
|||||||||||||
| 5. еҚ•йҖүйўҳ | |
|
жҹҗжё©еәҰдёӢпјҢ
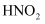 е’Ң е’Ң  зҡ„з”өзҰ»еёёж•°еҲҶеҲ«дёә зҡ„з”өзҰ»еёёж•°еҲҶеҲ«дёә  е’Ң е’Ң  гҖӮе°Ҷ гҖӮе°Ҷ  е’ҢдҪ“з§ҜеқҮзӣёеҗҢзҡ„дёӨз§Қй…ёжә¶ж¶ІеҲҶеҲ«зЁҖйҮҠпјҢе…¶ е’ҢдҪ“з§ҜеқҮзӣёеҗҢзҡ„дёӨз§Қй…ёжә¶ж¶ІеҲҶеҲ«зЁҖйҮҠпјҢе…¶  йҡҸеҠ ж°ҙдҪ“з§Ҝзҡ„еҸҳеҢ–еҰӮеӣҫжүҖзӨәгҖӮдёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜпјҲ пјү йҡҸеҠ ж°ҙдҪ“з§Ҝзҡ„еҸҳеҢ–еҰӮеӣҫжүҖзӨәгҖӮдёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . жӣІзәҝв… д»ЈиЎЁ
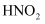 жә¶ж¶І
B . жә¶ж¶Ідёӯж°ҙзҡ„з”өзҰ»зЁӢеәҰпјҡbзӮ№пјһcзӮ№
C . д»ҺcзӮ№еҲ°dзӮ№пјҢжә¶ж¶Ідёӯ жә¶ж¶І
B . жә¶ж¶Ідёӯж°ҙзҡ„з”өзҰ»зЁӢеәҰпјҡbзӮ№пјһcзӮ№
C . д»ҺcзӮ№еҲ°dзӮ№пјҢжә¶ж¶Ідёӯ 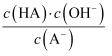 дҝқжҢҒдёҚеҸҳпјҲе…¶дёӯ дҝқжҢҒдёҚеҸҳпјҲе…¶дёӯ  гҖҒ гҖҒ  еҲҶеҲ«д»ЈиЎЁзӣёеә”зҡ„й…ёе’Ңй…ёж №зҰ»еӯҗпјү
D . зӣёеҗҢдҪ“з§ҜaзӮ№зҡ„дёӨжә¶ж¶ІеҲҶеҲ«дёҺ еҲҶеҲ«д»ЈиЎЁзӣёеә”зҡ„й…ёе’Ңй…ёж №зҰ»еӯҗпјү
D . зӣёеҗҢдҪ“з§ҜaзӮ№зҡ„дёӨжә¶ж¶ІеҲҶеҲ«дёҺ  жҒ°еҘҪдёӯе’ҢеҗҺпјҢжә¶ж¶Ідёӯ жҒ°еҘҪдёӯе’ҢеҗҺпјҢжә¶ж¶Ідёӯ 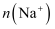 зӣёеҗҢ зӣёеҗҢ
|
|
| 6. еҚ•йҖүйўҳ | |
|
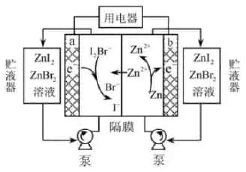
жҲ‘еӣҪ科еӯҰе®¶з ”еҲ¶дәҶдёҖз§Қж–°еһӢзҡ„й«ҳжҜ”иғҪйҮҸй”Ң-зўҳжәҙж¶ІжөҒз”өжұ пјҢе…¶е·ҘдҪңеҺҹзҗҶзӨәж„ҸеӣҫеҰӮдёӢгҖӮеӣҫдёӯиҙ®ж¶ІеҷЁеҸҜеӮЁеӯҳз”өи§ЈиҙЁжә¶ж¶ІпјҢжҸҗй«ҳз”өжұ зҡ„е®№йҮҸгҖӮ
A . ж”ҫз”өж—¶пјҢaз”өжһҒеҸҚеә”дёә
 B . ж”ҫз”өж—¶пјҢжә¶ж¶ІдёӯзҰ»еӯҗзҡ„ж•°зӣ®еўһеӨ§
C . е……з”өж—¶пјҢbз”өжһҒжҜҸеўһйҮҚ
B . ж”ҫз”өж—¶пјҢжә¶ж¶ІдёӯзҰ»еӯҗзҡ„ж•°зӣ®еўһеӨ§
C . е……з”өж—¶пјҢbз”өжһҒжҜҸеўһйҮҚ 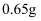 пјҢжә¶ж¶Ідёӯжңү пјҢжә¶ж¶Ідёӯжңү  иў«ж°§еҢ–
D . е……з”өж—¶пјҢaз”өжһҒжҺҘеӨ–з”өжәҗиҙҹжһҒ иў«ж°§еҢ–
D . е……з”өж—¶пјҢaз”өжһҒжҺҘеӨ–з”өжәҗиҙҹжһҒ
|
|
| 7. з»јеҗҲйўҳ | |
|
ж°®гҖҒзЈ·гҖҒз ·
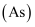 гҖҒй”‘ гҖҒй”‘  гҖҒй“Ӣ гҖҒй“Ӣ 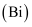 гҖҒй•Ҷ гҖҒй•Ҷ  дёәе…ғзҙ е‘ЁжңҹиЎЁдёӯеҺҹеӯҗеәҸж•°дҫқж¬ЎеўһеӨ§зҡ„еҗҢж—Ҹе…ғзҙ гҖӮеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ дёәе…ғзҙ е‘ЁжңҹиЎЁдёӯеҺҹеӯҗеәҸж•°дҫқж¬ЎеўһеӨ§зҡ„еҗҢж—Ҹе…ғзҙ гҖӮеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
|
|
| 8. з»јеҗҲйўҳ | |
|
жҲ‘еӣҪеҢ–еӯҰ家йҰ–ж¬Ўе®һзҺ°дәҶиҶҰеӮ¬еҢ–зҡ„
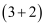 зҺҜеҠ жҲҗеҸҚеә”пјҢ并дҫқжҚ®иҜҘеҸҚеә”пјҢеҸ‘еұ•дәҶдёҖжқЎеҗҲжҲҗдёӯиҚүиҚҜжҙ»жҖ§жҲҗеҲҶиҢ…иӢҚжңҜйҶҮзҡ„жңүж•Ҳи·ҜзәҝгҖӮ зҺҜеҠ жҲҗеҸҚеә”пјҢ并дҫқжҚ®иҜҘеҸҚеә”пјҢеҸ‘еұ•дәҶдёҖжқЎеҗҲжҲҗдёӯиҚүиҚҜжҙ»жҖ§жҲҗеҲҶиҢ…иӢҚжңҜйҶҮзҡ„жңүж•Ҳи·ҜзәҝгҖӮ е·ІзҹҘ пјҲ еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
|
|
| 9. е®һйӘҢжҺўз©¶йўҳ | |
|
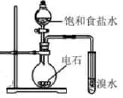
зҺҜе·ұзғҜжҳҜйҮҚиҰҒзҡ„еҢ–е·ҘеҺҹж–ҷгҖӮе…¶е®һйӘҢе®ӨеҲ¶еӨҮжөҒзЁӢеҰӮдёӢпјҡ
еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
|
|
| 10. з»јеҗҲйўҳ | |
|
еӨҡжҷ¶зЎ…жҳҜеҲ¶дҪңе…үдјҸз”өжұ зҡ„е…ій”®жқҗж–ҷгҖӮд»ҘдёӢжҳҜз”ұзІ—зЎ…еҲ¶еӨҮеӨҡжҷ¶зЎ…зҡ„з®Җжҳ“иҝҮзЁӢгҖӮ
еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
|
|
- еҗүжһ—зңҒй•ҝжҳҘеёӮ第151дёӯеӯҰ2019-2020еӯҰе№ҙй«ҳдәҢдёҠеӯҰжңҹеҢ–еӯҰжңҹдёӯиҖғиҜ•иҜ•еҚ·
- жІіеҢ—зңҒзҹіе®¶еә„еёӮ2020е№ҙй«ҳиҖғеҢ–еӯҰдәҢжЁЎиҜ•еҚ·
- 2019е№ҙй«ҳиҖғеҢ–еӯҰзңҹйўҳеҲҶзұ»жұҮзј–дё“йўҳ09пјҡе®һйӘҢеҢ–еӯҰ
- 2016е№ҙй«ҳиҖғзҗҶз»јзңҹйўҳиҜ•еҚ·пјҲеҢ–еӯҰйғЁеҲҶпјүпјҲеҢ—дә¬еҚ·пјү
- 2017е№ҙй«ҳиҖғзңҹйўҳеҲҶзұ»жұҮзј–пјҲеҢ–еӯҰпјүпјҡдё“йўҳ7 еҺҹз”өжұ гҖҒз”өи§Јжұ е·ҘдҪңеҺҹзҗҶеҸҠе…¶еә”з”Ё
- жІіеҢ—е”җеұұеёӮ2020е№ҙй«ҳиҖғеҢ–еӯҰдёҖжЁЎиҜ•еҚ·
- жұҹиӢҸзңҒеҚ—дә¬еёҲеӨ§йҷ„дёӯ2020е№ҙй«ҳиҖғеҢ–еӯҰдёҖжЁЎиҜ•еҚ·
- 2015-2016еӯҰе№ҙдә‘еҚ—зңҒжҳӯйҖҡеёӮдә‘еӨ©еҢ–дёӯеӯҰй«ҳдёҖдёӢеӯҰжңҹжңҹдёӯеҢ–еӯҰиҜ•еҚ·
- еұұдёңзңҒж—Ҙз…§еёӮ2019-2020еӯҰе№ҙй«ҳдёҖдёӢеӯҰжңҹеҢ–еӯҰжңҹжң«иҖғиҜ•иҜ•еҚ·
- 2015-2016еӯҰе№ҙжІіеҢ—зңҒйӮҜйғёеёӮйёЎжіҪгҖҒйҰҶйҷ¶гҖҒжҳҘе…үдёүеҺҝиҒ”иҖғй«ҳдёҖдёӢеӯҰжңҹжңҹдёӯеҢ–еӯҰиҜ•еҚ·
- 2016-2017еӯҰе№ҙеӣӣе·қзңҒеҫ·йҳіеёӮдёӯжұҹеҺҝйҫҷеҸ°дёӯеӯҰй«ҳдёҖдёҠеӯҰжңҹжңҹдёӯеҢ–еӯҰиҜ•еҚ·
- 2018е№ҙй«ҳиҖғзҗҶз»јеҢ–еӯҰзңҹйўҳиҜ•еҚ·пјҲеҢ—дә¬еҚ·пјү
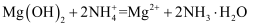

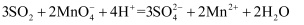
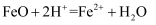



 ж°”дҪ“
ж°”дҪ“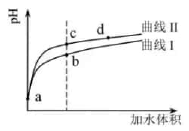
 зҡ„дёӯеӯҗж•°дёәгҖӮ
зҡ„дёӯеӯҗж•°дёәгҖӮ 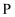 пјҲ
пјҲ  пјҢзҷҪзЈ·пјүпјқ
пјҢзҷҪзЈ·пјүпјқ  пјӣ
пјӣ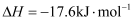 пјӣ
пјӣ
 пјҲеЎ«вҖңпјһвҖқвҖңпјңвҖқпјүгҖӮ
пјҲеЎ«вҖңпјһвҖқвҖңпјңвҖқпјүгҖӮ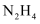
 пјҲеЎ«вҖңпјһвҖқвҖңпјңвҖқпјүпјҢеҲӨж–ӯдҫқжҚ®жҳҜгҖӮ
пјҲеЎ«вҖңпјһвҖқвҖңпјңвҖқпјүпјҢеҲӨж–ӯдҫқжҚ®жҳҜгҖӮ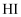 еҸҚеә”дә§зү©зҡ„жҺЁж–ӯжӯЈзЎ®зҡ„жҳҜпјҲеЎ«еәҸеҸ·пјүгҖӮ
еҸҚеә”дә§зү©зҡ„жҺЁж–ӯжӯЈзЎ®зҡ„жҳҜпјҲеЎ«еәҸеҸ·пјүгҖӮ  иғҪеҸ‘з”ҹиҫғејәзғҲзҡ„ж°ҙи§ЈпјҢз”ҹжҲҗйҡҫжә¶зҡ„
иғҪеҸ‘з”ҹиҫғејәзғҲзҡ„ж°ҙи§ЈпјҢз”ҹжҲҗйҡҫжә¶зҡ„ 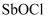 пјҢеҶҷеҮәиҜҘеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸпјҢеӣ жӯӨпјҢй…ҚеҲ¶
пјҢеҶҷеҮәиҜҘеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸпјҢеӣ жӯӨпјҢй…ҚеҲ¶ 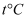 ж—¶еҸ‘з”ҹеҰӮдёӢеҸҚеә”пјҡ
ж—¶еҸ‘з”ҹеҰӮдёӢеҸҚеә”пјҡ в‘
в‘  в‘Ў
в‘Ў в‘ў
в‘ў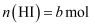 пјҢ
пјҢ 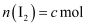 пјҢ
пјҢ 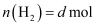 пјҢеҲҷ
пјҢеҲҷ 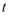 в„ғж—¶еҸҚеә”в‘ зҡ„е№іиЎЎеёёж•°
в„ғж—¶еҸҚеә”в‘ зҡ„е№іиЎЎеёёж•°  еҖјдёәпјҲз”Ёеӯ—жҜҚиЎЁзӨәпјүгҖӮ
еҖјдёәпјҲз”Ёеӯ—жҜҚиЎЁзӨәпјүгҖӮ
 гҖҒ
гҖҒ  еҸҜд»ҘжҳҜ
еҸҜд»ҘжҳҜ  жҲ–
жҲ–  пјү
пјү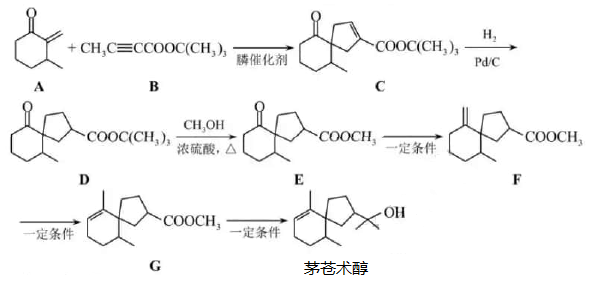

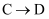 зҡ„еҸҚеә”зұ»еһӢдёәгҖӮ
зҡ„еҸҚеә”зұ»еһӢдёәгҖӮ
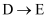 зҡ„еҢ–еӯҰж–№зЁӢејҸдёәпјҢйҷӨ
зҡ„еҢ–еӯҰж–№зЁӢејҸдёәпјҢйҷӨ 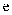 еӨ–иҜҘеҸҚеә”еҸҰдёҖдә§зү©зҡ„зі»з»ҹе‘ҪеҗҚдёәгҖӮ
еӨ–иҜҘеҸҚеә”еҸҰдёҖдә§зү©зҡ„зі»з»ҹе‘ҪеҗҚдёәгҖӮ
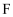 е’Ң
е’Ң 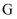 еҸҚеә”пјҢеҸҜз”ҹжҲҗзӣёеҗҢзҺҜзҠ¶дә§зү©зҡ„жҳҜпјҲеЎ«еәҸеҸ·пјүгҖӮ
еҸҚеә”пјҢеҸҜз”ҹжҲҗзӣёеҗҢзҺҜзҠ¶дә§зү©зҡ„жҳҜпјҲеЎ«еәҸеҸ·пјүгҖӮ  bпјҺ
bпјҺ 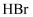 cпјҺ
cпјҺ 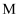 пјҢеңЁж–№жЎҶдёӯеҶҷеҮәи·ҜзәҝжөҒзЁӢеӣҫпјҲе…¶д»–иҜ•еүӮд»»йҖүпјүгҖӮ
пјҢеңЁж–№жЎҶдёӯеҶҷеҮәи·ҜзәҝжөҒзЁӢеӣҫпјҲе…¶д»–иҜ•еүӮд»»йҖүпјүгҖӮ 
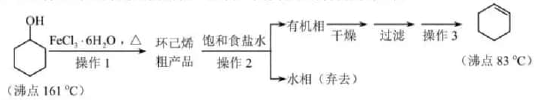
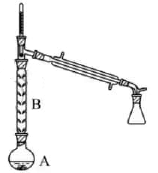
 иҖҢдёҚз”Ёжө“зЎ«й…ёзҡ„еҺҹеӣ дёәпјҲеЎ«еәҸеҸ·пјүгҖӮ
иҖҢдёҚз”Ёжө“зЎ«й…ёзҡ„еҺҹеӣ дёәпјҲеЎ«еәҸеҸ·пјүгҖӮ
 зҺҜе·ұзғҜж ·е“ҒдёӯеҠ е…Ҙе®ҡйҮҸеҲ¶еҫ—зҡ„
зҺҜе·ұзғҜж ·е“ҒдёӯеҠ е…Ҙе®ҡйҮҸеҲ¶еҫ—зҡ„  пјҢдёҺзҺҜе·ұзғҜе……еҲҶеҸҚеә”еҗҺпјҢеү©дҪҷзҡ„
пјҢдёҺзҺҜе·ұзғҜе……еҲҶеҸҚеә”еҗҺпјҢеү©дҪҷзҡ„ 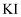 дҪңз”Ёз”ҹжҲҗ
дҪңз”Ёз”ҹжҲҗ  пјҢз”Ё
пјҢз”Ё 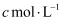 зҡ„
зҡ„  ж ҮеҮҶжә¶ж¶Іж»ҙе®ҡпјҢз»ҲзӮ№ж—¶ж¶ҲиҖ—
ж ҮеҮҶжә¶ж¶Іж»ҙе®ҡпјҢз»ҲзӮ№ж—¶ж¶ҲиҖ—  пјҲд»ҘдёҠж•°жҚ®еқҮе·ІжүЈйҷӨе№Іжү°еӣ зҙ пјүгҖӮ
пјҲд»ҘдёҠж•°жҚ®еқҮе·ІжүЈйҷӨе№Іжү°еӣ зҙ пјүгҖӮ


 еңЁ300в„ғж—¶еҸҚеә”з”ҹжҲҗ
еңЁ300в„ғж—¶еҸҚеә”з”ҹжҲҗ 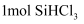 ж°”дҪ“е’Ң
ж°”дҪ“е’Ң  пјҢж”ҫеҮә
пјҢж”ҫеҮә 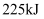 зғӯйҮҸпјҢиҜҘеҸҚеә”зҡ„зғӯеҢ–еӯҰж–№зЁӢејҸдёәгҖӮ
зғӯйҮҸпјҢиҜҘеҸҚеә”зҡ„зғӯеҢ–еӯҰж–№зЁӢејҸдёәгҖӮ 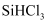 зҡ„з”өеӯҗејҸдёәгҖӮ
зҡ„з”өеӯҗејҸдёәгҖӮ
 ж°ўеҢ–дёә
ж°ўеҢ–дёә 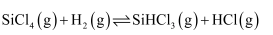
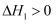
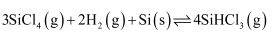

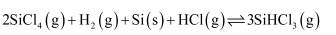

 жә¶ж¶ІеҲ¶еӨҮпјҢеҶҷеҮәдә§з”ҹ
жә¶ж¶ІеҲ¶еӨҮпјҢеҶҷеҮәдә§з”ҹ 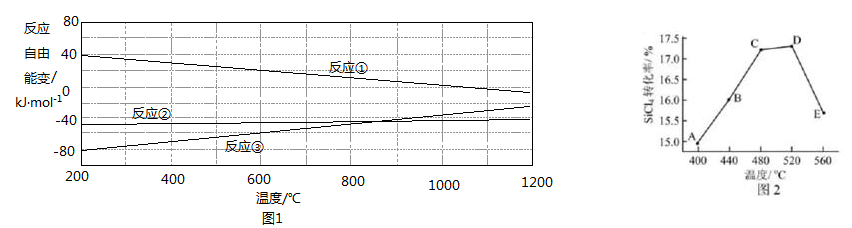
 пјҢ
пјҢ 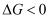 ж—¶еҸҚеә”иҮӘеҸ‘иҝӣиЎҢгҖӮдёүдёӘж°ўеҢ–еҸҚеә”зҡ„
ж—¶еҸҚеә”иҮӘеҸ‘иҝӣиЎҢгҖӮдёүдёӘж°ўеҢ–еҸҚеә”зҡ„ 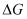 дёҺжё©еәҰзҡ„е…ізі»еҰӮеӣҫ1жүҖзӨәпјҢеҸҜзҹҘпјҡеҸҚеә”в‘ иғҪиҮӘеҸ‘иҝӣиЎҢзҡ„жңҖдҪҺжё©еәҰжҳҜпјӣзӣёеҗҢжё©еәҰдёӢпјҢеҸҚеә”в‘ЎжҜ”еҸҚеә”в‘ зҡ„
дёҺжё©еәҰзҡ„е…ізі»еҰӮеӣҫ1жүҖзӨәпјҢеҸҜзҹҘпјҡеҸҚеә”в‘ иғҪиҮӘеҸ‘иҝӣиЎҢзҡ„жңҖдҪҺжё©еәҰжҳҜпјӣзӣёеҗҢжё©еәҰдёӢпјҢеҸҚеә”в‘ЎжҜ”еҸҚеә”в‘ зҡ„ 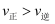 bпјҺ
bпјҺ 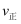 пјҡAзӮ№
пјҡAзӮ№ 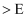 зӮ№ cпјҺеҸҚеә”йҖӮе®ңжё©еәҰпјҡ
зӮ№ cпјҺеҸҚеә”йҖӮе®ңжё©еәҰпјҡ 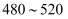 в„ғ
в„ғ пјҲз”Ё
пјҲз”Ё 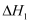 пјҢ
пјҢ 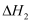 иЎЁзӨәпјүгҖӮжё©еәҰеҚҮй«ҳпјҢеҸҚеә”в‘ўзҡ„е№іиЎЎеёёж•°
иЎЁзӨәпјүгҖӮжё©еәҰеҚҮй«ҳпјҢеҸҚеә”в‘ўзҡ„е№іиЎЎеёёж•°  еӨ–пјҢиҝҳжңүпјҲеЎ«еҲҶеӯҗејҸпјүгҖӮ
еӨ–пјҢиҝҳжңүпјҲеЎ«еҲҶеӯҗејҸпјүгҖӮ



