安徽省A10联盟2019-2020学年高三下学期化学开学考试卷
安徽省A10联盟2019-2020学年高三下学期化学开学考试卷
教材版本:化学
试卷分类:化学高三下学期
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
教材版本:化学
试卷分类:化学高三下学期
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 综合题 | |
|
某菱镁矿主要成分是MgCO3 , 还含有Al2O3、FeCO3、Fe2O3、SiO2等杂质,由该菱镁矿制备高纯MgO的流程如图。回答下列问题:
|
|
| 2. 单选题 | |
|
中华文明源远流长,下列有关中国文化的说法错误的是( )
A . 黑陶是我国艺术瑰宝,陶瓷烧制过程中发生了化学变化
B . 何以解忧?唯有杜康古代酿酒过程中采用了蒸馏提纯方法
C . 马踏飞燕属于青铜器,青铜的熔点和硬度都远高于纯铜
D . “司南之杓,投之于地其杓柄指南”,“杓”的材料是Fe3O4
|
|
| 3. 单选题 | |
|
如图是盛放液溴的试剂瓶剖面图,仔细观察分成了明显的气相、溴溶液相和液溴相三相,下列说法错误的是( )
A . 气相呈现红棕色,因为其中含有Br2的蒸汽
B . 溴溶液相中显酸性,主要因为HBr电离出了H+
C . 液溴保存时加水形成水封的目的是减少Br2的挥发
D . 液溴保存时不可敞口放置,应保存在细口瓶中并塞上橡胶塞
|
|
| 4. 单选题 | |
|
X、Y、Z、W是原子序数依次增大的短周期主族元素,X与W在同一主族,X是地壳中含量最多的元素,X、W的最外层电子数之和是Y、Z最外层电子数之和的3倍,下列说法正确的是( )
A . 原子半径:W>Z>Y>X
B . 最简单氢化物的稳定性:X>W
C . 最高价氧化物对应水化物的碱性:Z>Y
D . X、Y形成的某种化合物可作供氧剂,其阴阳离子个数比为1:1
|
|
| 5. 单选题 | |
|
下列对两种有机物甲和乙的描述错误的是( )
A . 甲中所有碳原子不可能在同一平面上
B . 甲、乙均能发生加成反应、氧化反应、取代反应
C . 甲、乙均能在一定条件下通过聚合反应生成高聚物
D . 甲、乙苯环上的一硝基取代物种数相同(不考虑立体异构)
|
|
| 6. 单选题 | |||||||||||||||||||||
|
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
A . A
B . B
C . C
D . D
|
|||||||||||||||||||||
| 7. 单选题 | |
|
乙醛酸(OHC-COOH )是一种重要的精细化工产品。以高硅铸铁为惰性电极材料,用恒电势电解NaBr 溶液间接氧化乙二醛(OHC-CHO)制备乙醛酸:OHC-CHO+Br2+H2O→OHC-COOH+2HBr。装置如图所示,下列说法错误的是( )
A . 电极b为负极,高硅铸铁不损耗
B . 阳极的电极反应式为2Br--2e-=Br2
C . 光伏电池将铸铁极的电子转移到石墨极
D . 电解过程中,右室溶液的pH逐渐升高
|
|
| 8. 单选题 | |
|
已知298K时,Ksp(MnS)=4.65×10-14 , Ksp(MnCO3)=2.24×10-11 , 298K下,MnS、MnCO3(R2-代表S2-或CO32-)在水中的溶解曲线如图所示:
下列说法正确的是( )
A . 图象中x约等于5.0×10-6
B . 其它条件不变,加热N的悬浊液可使溶液组成由e点沿ef线向f点方向移动
C . 常温下,加水稀释M溶液可使溶液组成由d点沿df线向f点方向移动
D . 向含有MnS和MnCO3的饱和溶液中加少量MnCl2 , c(CO32-)/c(S2-)增大
|
|
| 9. 综合题 | |||||||||||||||||
|
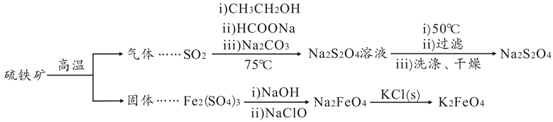
连二亚硫酸钠(Na2S2O4)是印刷行业重要的还原剂,易溶于水,难溶于乙醇;高铁酸钾(K2FeO4)是一种绿色环保型饮用水处理剂。某课题小组拟以硫铁矿(主要成分是FeS2)为主要原料制备连二亚硫酸钠和高铁酸钾,其简易工艺流程如下(部分步骤和条件略去):
|
|||||||||||||||||
| 10. 综合题 | |
|
德国化学家哈伯(F.Haber)从1902年开始研究由氮气和氢气直接合成氨。合成氨为解决世界的粮食问题作出了重要贡献。其原理为N2(g)+3H2(g)⇌2NH3(g) △H=-92.4kJ/mol
|
|
高中化学 试卷推荐
- 湖北省孝感市八校教学联盟2017-2018学年高一下学期化学期末考试试卷
- 2017年高考化学备考复习专题十二:重要的有机化合物
- 专题12:氮族元素及其化合物
- 广东省茂名市高州中学2016-2017学年高二上学期化学期中考试试卷(理科)
- 江苏省徐州市2019-2020学年高二下学期化学期末考试试卷
- 2016-2017学年辽宁省大连市高二上学期期末化学试卷(文科)
- 2015年海南省保亭中学高考化学模拟试卷(二)
- 辽宁省辽南协作校2020年高考化学一模试卷
- 广东省惠州市惠阳高中2015-2016学年高一下学期化学期中考试试卷
- 辽宁省辽阳2017-2018学年高一化学期末考试题
- 2015-2016学年贵州省黔南州高二下学期期末化学试卷
- 内蒙古赤峰市2019-2020学年高一下学期化学期末考试试卷
最近更新

 在(填仪器名称)中进行高温焙烧得到的MgO质量为8.0g,则x=。
在(填仪器名称)中进行高温焙烧得到的MgO质量为8.0g,则x=。




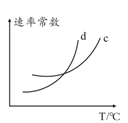
 N的键能约为kJ/mol
N的键能约为kJ/mol

 ,v逆=K逆∙c2(NH3),则一定温度下,该反应 的平衡常数K=(用含K正和K逆的表达式表示),若K正和K逆都是温度的函数,且随温度升高而升高,则图中c和d分别表示和随温度变化趋势(填K正或者K逆)。
,v逆=K逆∙c2(NH3),则一定温度下,该反应 的平衡常数K=(用含K正和K逆的表达式表示),若K正和K逆都是温度的函数,且随温度升高而升高,则图中c和d分别表示和随温度变化趋势(填K正或者K逆)。