2018年高考理综化学真题试卷(全国Ⅰ卷)
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
硫酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一,采用湿法冶金工艺回收废旧硫酸亚铁锂电池正极片中的金属,其流程如下:
下列叙述错误的是( )
A . 合理处理废旧电池有利于保护环境和资源再利用
B . 从“正极片”中可回收的金属元素有Al、Fe、Li
C . “沉淀”反应的金属离子为Fe3+
D . 上述流程中可用硫酸钠代替碳酸钠
|
|
| 2. 多选题 | |
|
下列说法错误的是( )
A . 蔗糖,果糖和麦芽糖均为双糖
B . 酶是一类具有高选择催化性能的蛋白质
C . 植物油含不饱和脂肪酸酯,能使Br₂/CCl4色
D . 淀粉和纤维素水解的最终产物均为葡萄糖
|
|
| 3. 单选题 | |
|
在生成和纯化乙酸乙酯的实验过程中,下列操作未涉及的是( )
A .
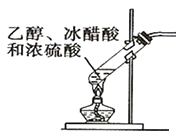 B .
B .  C .
C .  D .
D . 
|
|
| 4. 单选题 | |
|
NA是阿伏加德罗常数的值,下列说法正确的是( )
A . 16.25gFeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA
B . 22.4L(标准状况)氩气含有的质子数为18NA
C . 92.0g甘油(丙三醇)中含有羟基数为1.0NA
D . 1.0molCH4与Cl2在光照下反应生成的CH3Cl分子数为1.0NA
|
|
| 5. 单选题 | |
|
环之间共用一个碳原子的化合物称为螺环化合物,螺[22]戊烷(
A . 与环戊烯互为同分异构体
B . 二氯代物超过两种
C . 所有碳原子均处同一平面
D . 生成1mol C5H12至少需要2molH2
|
|
| 6. 单选题 | |
|
主族元素W、X、Y、Z的原子序数依次增加,且均不大于20,W、X、Z最外层电子数之和为10;W与Y同族;W与Z形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃。下列说法正确的是( )
A . 常温常压下X的单质为气态
B . Z的氢化物为离子化合物
C . Y和Z形成的化合物的水溶液呈碱性
D . W与Y具有相同的最高化合价
|
|
| 7. 单选题 | |
|
最近我国科学家设计了一种,CO₂+H₂S协同转化装置,实现对天然气中CO₂和H₂S的高效去除。示意图如右所示,其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为:
①EDTA-Fe2+-e-=EDTA-Fe3+ ②2EDTA-Fe3++H₂S=2H++S+2EDTA+Fe²+ 该装置工作时,下列叙述错误的是( )
A . 阴极的电极反应:CO₂+2H++2e-=CO+H₂O
B . 协同转化总反应:CO₂+H₂S=CO+H₂O+S
C . 石墨烯上的电势比ZnO@石墨烯上的低
D . 若采用Fe²+/Fe3+取代EDTA-Fe²+/EDTA-Fe3+ , 溶液需为酸性
|
|
| 8. 实验探究题 | |
|
醋酸亚铬[( CH3 COO)₂Cr·2H₂O]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂,一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示,回答下列问题:
|
|
| 9. 综合题 | |
|
焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛,回答下列问题:
|
|
| 10. 实验探究题 | |||||||||||||||||||
|
采用N2O5为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用,回答下列问题:
|
|||||||||||||||||||



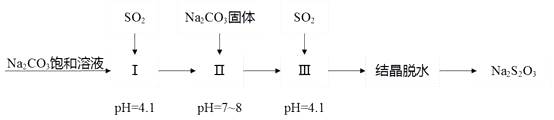 ①pH=4.1时,1中为溶液(写化学式)。
①pH=4.1时,1中为溶液(写化学式)。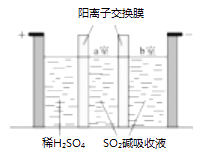

 O2(g)的△H= kJ·mol-1
O2(g)的△H= kJ·mol-1 (KPa·min-1),t=62min时,测得体系中
(KPa·min-1),t=62min时,测得体系中  =2.9kPa,则此时的
=2.9kPa,则此时的  = kPa,V= kPa,min-1。
= kPa,V= kPa,min-1。


