2017年高考理综冲刺100题(每天1练):21-30题
2017年高考理综冲刺100题(每天1练):21-30题
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 多选题 | |
|
制备下列有机化合物时,常会混有括号内的杂质,以下除杂方法正确的是( )
A . 苯(甲苯):加酸性高锰酸钾溶液、再加NaOH溶液,分液
B . 乙烷(乙烯),催化条件下通入H2
C . 乙酸(乙醛),加入新制氢氧化铜,蒸馏
D . 乙醛(乙酸),加入氢氧化钠溶液洗涤,蒸馏
|
|
| 2. 单选题 | |
|
下列叙述中,错误的是( )
A . 苯与浓硝酸、浓硫酸共热并保持55~60℃反应生成硝基苯
B . 苯乙烯在合适条件下催化加氢可生成乙基环己烷
C . 乙烯和溴的四氯化碳溶液反应生成1,2﹣二溴乙烷
D . 甲苯与氯气在光照下反应主要生成2,4﹣二氯甲苯
|
|
| 3. 单选题 | |
|
下列说法正确的是( )
A . 按系统命名法,化合物
 的名称是2,3,5,5﹣四甲基﹣4,4﹣二乙基己烷
B . 用酸性KMnO4 溶液可鉴别2﹣丁烯和正丁醛
C . 用甘氨酸[H2N﹣CH2﹣COOH]和丙氨酸[CH3CH(NH2)COOH]缩合最多可形成3 种二肽
D . 乙醇、乙二醇、丙三醇的沸点依次升高 的名称是2,3,5,5﹣四甲基﹣4,4﹣二乙基己烷
B . 用酸性KMnO4 溶液可鉴别2﹣丁烯和正丁醛
C . 用甘氨酸[H2N﹣CH2﹣COOH]和丙氨酸[CH3CH(NH2)COOH]缩合最多可形成3 种二肽
D . 乙醇、乙二醇、丙三醇的沸点依次升高
|
|
| 4. 单选题 | |
|
葛根素具有降血压等作用,其结构简式如图,下列有关说法正确的是( )
A . 该物质在一定条件下能发生消去反应、加成反应、取代反应
B . 葛根素的分子式为C21H22O9
C . 该物质在一定条件下能与碳酸氢钠溶液反应
D . 一定条件下1 mol 该物质与H2反应最多能消耗7 mol H2
|
|
| 5. 单选题 | |
|
下列关于乙烯的说法正确的是( )
A . 是天然气的主要成分
B . 不能使稀的酸性高锰酸钾溶液褪色
C . 是一种植物生长调节剂
D . 是聚乙烯塑料袋的主要成分
|
|
| 6. 单选题 | |
|
自然界存在反应:14CuSO4+5FeS2+12H2O→7Cu2S+5FeSO4+12H2SO4 . 在该反应中( )
A . 产物中的SO
 有一部分是氧化产物
B . 5molFeS2发生反应,有10mol电子转移
C . 发生氧化反应和发生还原反应的FeS2之比为7:3
D . 14mol CuSO4能氧化5molFeS2 有一部分是氧化产物
B . 5molFeS2发生反应,有10mol电子转移
C . 发生氧化反应和发生还原反应的FeS2之比为7:3
D . 14mol CuSO4能氧化5molFeS2
|
|
| 7. 单选题 | |
|
根据下列热化学方程式
① C(s)+O2(g)═CO2 (g)△H1=﹣393.5kJ/mol ② H2(g)+ ③ CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H3=﹣870.3kJ/mol 可以计算出2C(s)+2H2(g)+O2(g)═CH3COOH(l)的反应热为( )
A . △H=﹣488.3 kJ/mol
B . △H=+244.1 kJ/mol
C . △H=﹣996.6 kJ/mol
D . △H=+996.6 kJ/mol
|
|
| 8. 多选题 | |
|
下列有关元素周期律的叙述,正确的是( )
A . 随着原子序数的递增,原子最外层电子总是从1到8重复出现
B . 元素的性质随着元素原子序数的递增而呈周期性变化
C . 随着元素原子序数的递增,元素最高正价从+1到+7,负价从﹣7到﹣1重复出现
D . 元素性质的周期性变化是指原子核外电子排布的周期性变化、原子半径的周期性变化以及元素主要化合价的周期性变化
|
|
| 9. 实验探究题 | |
|
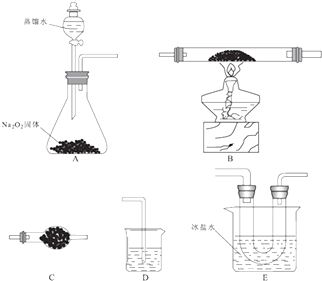
已知氯化亚铁的熔点674℃、沸点1023℃;三氯化铁在300℃以上易升华,易溶于水并且有强烈的吸水性.在500℃条件下氯化亚铁与氧气可能发生多种反应,反应之一为:12FeCl2+3O2
 2Fe2O3+8FeCl3 . 某研究小组选用以下装置(夹持装置省略,装置可重复选用)进行反应的探究.回答下列问题: 2Fe2O3+8FeCl3 . 某研究小组选用以下装置(夹持装置省略,装置可重复选用)进行反应的探究.回答下列问题:
|
|
| 10. 综合题 | |
|
N和Si是合成新型非金属材料的两种重要元素.请回答:
|
|
最近更新

 O2(g)═H2O(l)△H2=﹣285.8kJ/mol
O2(g)═H2O(l)△H2=﹣285.8kJ/mol