四川省遂宁市2022届高三第二次诊断性考试(二模)理综化学试题
四川省遂宁市2022届高三第二次诊断性考试(二模)理综化学试题
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
化学与社会、生产和生活密切相关。下列说法不正确的是( )
A . 研究高效合成氨有利于提高粮食产量
B . 大量鲜花的香味主要来自酯的混合物
C . 液化石油气是一种可再生的清洁能源
D . 采用喷涂油漆法可以防止钢铁的腐蚀
|
|
| 2. 单选题 | |
|
2022年世界大运会场馆用到一种耐腐的表面涂料M(结构如图)。该涂料在酸性环境下可以水解为有机物甲和有机物乙,下列说法正确的是( )
A . M分子含有苯环和酯基
B . 甲、乙互为同分异构体
C . M能使溴的水溶液褪色
D . 1mol M最多能与2mol NaOH反应
|
|
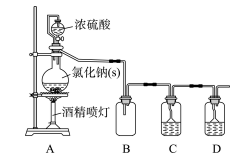
| 3. 单选题 | ||||||||||||||||
|
下列相关实验方案正确的是( )
A . A
B . B
C . C
D . D
|
||||||||||||||||
| 4. 单选题 | |
|
常温下,下列各组离子在指定溶液中能大量共存的是( )
A . 在澄清透明的溶液中:Fe3+、Mn2+、
 、Cl-
B . 能使甲基橙显红色的溶液中:Zn2+、H+、ClO-、I-
C . 含0.1mol·L-1 NaHSO4的溶液:K+、Al3+、 、Cl-
B . 能使甲基橙显红色的溶液中:Zn2+、H+、ClO-、I-
C . 含0.1mol·L-1 NaHSO4的溶液:K+、Al3+、 、 、 D .
D .  =1.0×10-12的溶液: =1.0×10-12的溶液: 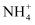 、Na+、HCO 、Na+、HCO 、 、
|
|
| 5. 单选题 | |||||||||
|
X、Y、Z、W属于短周期主族元素,其中X、Y、Z在元素周期表中的相对位置关系如图,Y原子的最外层电子数是其次外层电子数的
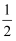 , W的焰色反应呈现黄色火焰。下列说法不正确的是( ) , W的焰色反应呈现黄色火焰。下列说法不正确的是( )
A . 原子半径:W>Y>Z>X
B . W和X形成的化合物可能含共价键
C . 气态氢化物的稳定性X>Z>Y
D . Z2X5可以用作食品干燥剂
|
|||||||||
| 6. 单选题 | |
|
太阳能发电和阳光分解水是清洁能源研究的主攻方向。染料敏化的TiO2纳米晶薄膜半导体光解水的基本原理如图,下列对该装置的相关说法不正确的是( )
A . SO
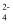 由甲电极向乙电极定向移动
B . 甲电极反应为 由甲电极向乙电极定向移动
B . 甲电极反应为 C . 电池总反应为
C . 电池总反应为 D . 实现光能→电能→化学能的转换
D . 实现光能→电能→化学能的转换
|
|
| 7. 单选题 | |
|
常温时,用0.1000mol·L-1 NaOH溶液滴定25.00mL 0.1000 mol·L-1一元弱酸HR的溶液,滴定过程中pH变化曲线如图所示(溶液体积近似可以加和),则下列判断正确的是( )
A . A点时,
 B . 常温下,HR的Ka的数量级为10-4
C . B点时,
B . 常温下,HR的Ka的数量级为10-4
C . B点时, D . B点和C点,水的电离程度相同
D . B点和C点,水的电离程度相同
|
|
| 8. 实验探究题 | |
|
严谨的实验设计能有效规避实验风险,能重复实验并得到相同的结果。由粗盐制备试剂级的NaCl的相关实验步骤和装置如下:
【粗盐的提纯】 第I步:称取20.0g粗盐(含MgCl2、CaCl2、Na2SO4杂质),用80mL水溶解,加入1.0mol/L BaCl2至观察不到明显沉淀为止,用倾析法分离,保留滤液。 第II步:向滤液中先后加入过量2.0mol/L NaOH、1.0mol/L Na2CO3 , 过滤,再用3.0mol/L HCl调节pH至1~2。 第III步,加热浓缩至溶液刚刚出现微晶膜。
|
|
| 9. 实验探究题 | |||||||||||
|
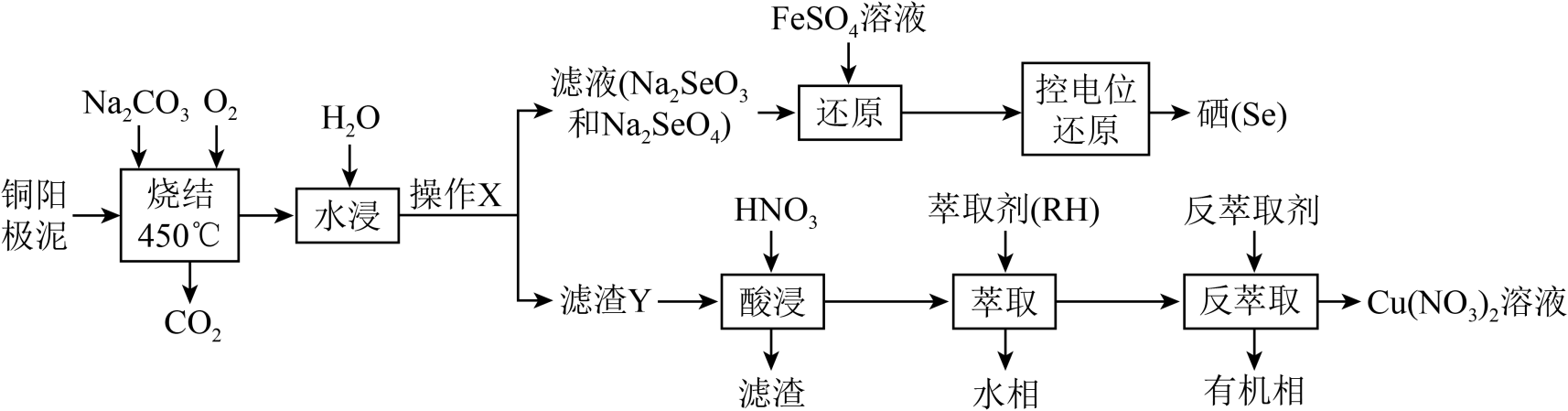
用粗铜精炼工业中产生的铜阳极泥(主要含Cu2Se、Ag2Se、金和铂等)为原料,回收并制备硝酸铜和硒的工艺流程如图:
|
|||||||||||
| 10. 综合题 | |
|
CH4-CO2干重整技术是利用CH4处理CO2并获得CO和H2 , 相关重整反应为:CH4(g)+CO2(g)
 2CO(g)+2H2(g) ΔH。回答下列问题: 2CO(g)+2H2(g) ΔH。回答下列问题:
|
|
最近更新

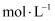 的
的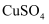 溶液
溶液 溶于100mL水中并充分搅拌
溶于100mL水中并充分搅拌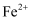 有还原性
有还原性 溶液中滴加少量
溶液中滴加少量 溶液,观察紫色是否变浅
溶液,观察紫色是否变浅 、
、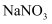 溶液的pH,通过pH的大小判断
溶液的pH,通过pH的大小判断 溶液,观察是否有气体逸出
溶液,观察是否有气体逸出

 _
_ _
_ _
_ _
_ _
_

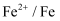
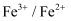

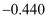
 、Fe3+和Cu2+的氧化性由强到弱的顺序为,在0.740V时Fe3+优先被还原,其还原反应(半反应)式为。
、Fe3+和Cu2+的氧化性由强到弱的顺序为,在0.740V时Fe3+优先被还原,其还原反应(半反应)式为。

 加入恒容容器中,当反应达平衡时CH4的转化率为80%,CO2的转化率为90%。经分析,该容器中同时发生了副反应:CO2(g)+H2(g)
加入恒容容器中,当反应达平衡时CH4的转化率为80%,CO2的转化率为90%。经分析,该容器中同时发生了副反应:CO2(g)+H2(g) 



