安徽省皖南名校2020-2021学年高二上学期化学期中考试试卷
安徽省皖南名校2020-2021学年高二上学期化学期中考试试卷
教材版本:化学
试卷分类:化学高二上学期
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
教材版本:化学
试卷分类:化学高二上学期
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图所示。下列说法错误的是( )
A . 盐酸的浓度越大,腐蚀速率越快
B . 钼酸钠和月桂酰肌氨酸的浓度相等时,腐蚀速率最小
C . 碳素钢的腐蚀速率不随硫酸的浓度增大而增大,说明反应速率不与c(H+)成正比
D . 对比盐酸和硫酸两条曲线,可知Cl-也会影响碳素钢的腐蚀速率
|
|
| 2. 单选题 | |
|
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是( )
A . 1mol N2(g)和1mol O2(g)完全反应放出的能量为180kJ
B . 通常情况下,N2(g)和O2(g)混合能直接生成NO
C . 1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量
D . NO是一种红棕色的气体,能与水反应生成硝酸
|
|
| 3. 计算题 | |
|
|
| 4. 单选题 | |
|
下列民俗、诗句、谚语等包含吸热反应的是( )
A . 民间焰火之最——确山打铁花
B . 千锤万凿出深山,烈火焚烧若等闲
C . 只要功夫深,铁杵磨成针
D . 冰,水为之,而寒于水
|
|
| 5. 单选题 | |
|
对化学反应速率和平衡的研究具有十分重要的意义,下列认识正确的是( )
A . 用冰箱冷藏食物,能使其永远不腐败变质
B . 尾气转化催化剂可以完全消除汽车尾气污染
C . 调整反应条件无法使可逆反应正向进行到底
D . 化学反应速率越快可逆反应正向进行的程度越大
|
|
| 6. 单选题 | |
|
能源与可持续发展密切相关,下列说法正确的是( )
A . 直接开采的化石燃料完全燃烧不会造成大气污染
B . 从海洋中开采的“可燃冰”释放出的气体与天然气成分相同
C . 二氧化碳、水通过人工光合作用生成有机物同时放出能量
D . “干热岩”(温度大于
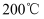 的高温岩体)是最具应用价值和利用潜力的清洁能源,该能源属于化石能源 的高温岩体)是最具应用价值和利用潜力的清洁能源,该能源属于化石能源
|
|
| 7. 单选题 | |
|
被称为人体冷冻学之父的罗伯特·埃廷格在1962年写出《不朽的前景》一书。他在书中列举了大量事实,证明了冷冻复活的可能。比如,许多昆虫和低等生物冬天都冻僵起来,春天又自动复活。下列结论中与上述信息相关的是( )
A . 化学反应前后质量守恒
B . 低温下分子无法运动
C . 温度降低,化学反应停止
D . 温度越低,化学反应越慢
|
|
| 8. 单选题 | |
|
下列有关化学反应速率和化学平衡的说法错误的是( )
A . 对于化学反应来说,反应速率越快,反应现象不一定越明显
B . N2(g)+3H2(g)
 2NH3(g) ΔH<0,其他条件不变时,升高温度,反应速率υ(H2)和氢气的平衡转化率均增大
C . 化学反应速率理论可指导怎样在一定时间内快出产品,化学平衡理论可指导怎样用有限的原料多出产品
D . CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH>0 2NH3(g) ΔH<0,其他条件不变时,升高温度,反应速率υ(H2)和氢气的平衡转化率均增大
C . 化学反应速率理论可指导怎样在一定时间内快出产品,化学平衡理论可指导怎样用有限的原料多出产品
D . CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH>0
|
|
| 9. 单选题 | |
|
对于XOH型化合物而言(X是除H,O外的其它元素),下列说法中正确的是( )
A . XOH的水溶液不能导电
B . XOH不可能是酸
C . 当X是碱金属时,它一定是强碱
D . XOH一定是共价化合物
|
|
| 10. 单选题 | |
|
下列化学方程式中,正确的是( )
A . 甲烷的燃烧热△H=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ/mol
B . 一定条件下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3放热akJ,其热化学方程式为:N2(g)+3H2(g)
 2NH3(g)△H=-2akJ/mol
C . 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol
D . HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2发生中和反应生成2molH2O的反应热△H=-114.6kJ/mol 2NH3(g)△H=-2akJ/mol
C . 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol
D . HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2发生中和反应生成2molH2O的反应热△H=-114.6kJ/mol
|
|
高中化学 试卷推荐
- 辽宁省锦州市滨海新区2018-2019学年上学期11月-12月高一化学月考测试卷
- 黑龙江省海林市朝鲜族中学2019-2020学年高三上学期化学期末考试试卷
- 2016年宁夏银川市长庆高级中学高考化学一模试卷
- 吉林长春市榆树高级中学2019-2020学年高二下学期化学期末考试试卷
- 备考2018年高考化学一轮基础复习:专题27 化石燃料与有机化合物
- 北京市丰台区2018-2019学年高二上学期化学期中考试试卷
- 湖南省株洲市2017-2018学年高考理综-化学二模考试试卷
- 北京市东城区2015-2016学年高一上学期化学期末考试试卷
- 2016年上海市闵行区高考化学一模试卷
- 2015-2016学年四川省资阳市高一上学期期末化学试卷
- 福建省龙岩市2017-2018学年高考理综-化学4月模拟考试试卷
- 2015-2016学年广东省茂名市高州中学高二下学期期末化学试卷
最近更新


 。请回答下列问题:
。请回答下列问题:  c.c(H+)与c(OH-)的乘积 d.c(OH-)
c.c(H+)与c(OH-)的乘积 d.c(OH-)


