高中化学人教版(2019)必修第一册第四章实验活动3 同周期、同主族元素性质的递变
高中化学人教版(2019)必修第一册第四章实验活动3 同周期、同主族元素性质的递变
教材版本:化学
试卷分类:化学高一上学期
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
教材版本:化学
试卷分类:化学高一上学期
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 综合题 | |
|
卤族元素的单质(F2、Cl2、Br2、I2)与H2反应过程中的能量变化如右图所示,其中a、b、c、d分别表示卤族中某一元素的单质,△E为相同物质的量的单质与H2反应过程中的能量变化(△E越大,表明反应越容易发生).请回答下列问题:
|
|
| 2. 填空题 | |
|
根据金属钠、钾与水反应的现象,推断锂、钠、钾、铷各1g分别与足量的水反应,其中反应最剧烈的金属是,相同条件下,放出氢气的体积最大的是.
|
|
| 3. 多选题 | |
|
下列有关卤素单质及其化合物的说法正确的是( )
A . 卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易
B . 卤化氢的稳定性按HF、HCl、HBr、HI的顺序依次增大
C . 卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
D . 卤化银的颜色按AgCl、AgBr、AgI的顺序依次加深
|
|
| 4. 综合题 | |
|
溴化碘(IBr)的化学性质类似于卤素单质,试回答下列问题:
|
|
| 5. 推断题 | |
|
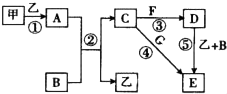
下列框图中的物质均为中学化学中常见物质,其中甲、乙为单质,其余均为化合物.B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色.
请回答下列问题:
|
|
| 6. 填空题 | |
|
卤族元素包括元素,它们原子的最外层都有个电子,在化学反应中易得到个电子,因此均体现出较强的氧化性;但从F到I,电子层数依次增多,原子半径逐渐,原子核对最外层电子的引力逐渐,所以非金属性逐渐,单质的氧化性逐渐。
|
|
| 7. 单选题 | |
|
下列结构示意图表示的元素不属于碱金属元素的是( )
A .
 D .
D . |
|
| 8. 单选题 | |
|
在下列元素中,与氢气反应最剧烈的是( )
A . 氟
B . 氯
C . 溴
D . 碘
|
|
| 9. 单选题 | |
|
随着卤素原子半径的增大,下列递变规律正确的是( )
A . 单质的熔点逐渐降低
B . 单质氧化性逐渐增强
C . 气态氢化物稳定性逐渐增强
D . 卤素离子还原性逐渐增强
|
|
| 10. 单选题 | |
|
下列关于碱金属元素和卤素的说法中正确的是( )
A . 卤素单质越活泼,其熔沸点就越低
B . 卤素单质都能和水剧烈反应
C . 碱金属均能沉于煤油下方
D . 碱金属在空气中加热均能生成多种氧化物
|
|
高中化学 试卷推荐
- 江苏省南京市2017-2018学年高考理综-化学三模考试试卷
- 2017_2018学年高中化学人教版选修三 课时训练11溶解性、手性、无机含氧酸分子的酸性
- 人教(新课标)高中化学一轮复习:专题12电化学
- 2016年福建省泉州市高考化学模拟试卷(3月份)
- 浙江省金华十校2016-2017学年高二下学期化学期末考试试卷
- 河南省驻马店市2016-2017学年高二下学期化学期末考试试卷
- 2016-2017学年新疆伊犁州伊宁二中高三上学期开学化学试卷
- 2015-2016学年广西南宁市马山县高二下学期期末化学试卷
- 广东省东莞市光明中学2019-2020学年高三下学期化学第一次月考试卷
- 2015-2016学年河南省鹤壁市淇县一中高二下学期期中化学试卷
- 高中化学人教版(2019)必修第一册第一章第一节 物质的分类及转化
- 湖北省荆门市2016-2017学年化学高一上学期期末考试试卷
最近更新