安徽省马鞍山市2021年高考化学一模试卷
安徽省马鞍山市2021年高考化学一模试卷
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
佩戴口罩能有效预防新冠疫情扩散。有关口罩的知识,下列说法正确的是( )
A . 古人使用丝巾遮盖口鼻,丝巾的主要成分是蛋白质
B . 医用口罩过滤层由聚丙烯熔喷布构成,熔喷布是天然高分子材料
C . 一次性防尘口罩可防烟、雾,烟、雾的分散质是空气
D . 氯气泄漏时,可戴上用NaOH溶液润湿过的口罩
|
|
| 2. 单选题 | |
|
碳酸亚乙酯(
A . 所有原子共平面
B . 能与NaOH溶液反应
C . 不能发生氧化反应
D . 无链状同分异构体
|
|
| 3. 单选题 | |
|
W、X、Y、Z是原子序数依次增大的短周期主族元素,W、Y分别与X形成的化合物均会导致酸雨。下列说法中一定正确的是( )
A . 简单离子半径中最大的是Z
B . 简单氢化物中熔沸点最高的是X
C . 氧化物对应水化物的酸性Z比Y强
D . W的氢化物分子含10个电子
|
|
| 4. 单选题 | ||||||||||||||||
|
根据下列实验操作和现象,所得结论或推论正确的是( )
A . A
B . B
C . C
D . D
|
||||||||||||||||
| 5. 单选题 | |
|
我国科研人员通过控制光沉积的方法构建Cu2O-Pt/SiC/IrOx型复合材料光催化剂,其中Fe2+和Fe3+离子渗透Nafion膜可协同CO2、H2O分别反应,构建了一个人工光合作用体系,其反应机理如图:
下列说法错误的是( )
A . 该反应为2CO2+2H2O
 2HCOOH+O2
B . 该反应能量转化形式为光能→化学能
C . 图中a、b分别代表Fe2+、Fe3+
D . 反应过程中涉及到非极性键、极性键的断裂和形成 2HCOOH+O2
B . 该反应能量转化形式为光能→化学能
C . 图中a、b分别代表Fe2+、Fe3+
D . 反应过程中涉及到非极性键、极性键的断裂和形成
|
|
| 6. 单选题 | |
|
NCl3是一种黄色黏稠状液体,可用于制备新型消毒剂ClO2 , 其制备装置如图所示。下列说法正确的是( )
A . Pt极发生氧化反应,可用淀粉-KI试纸检验M
B . 石墨极的反应式为
 C . 电解过程中,质子交换膜右侧溶液pH会增大
D . 每生成1mol NCl3 , 会生成67.2L气体M
C . 电解过程中,质子交换膜右侧溶液pH会增大
D . 每生成1mol NCl3 , 会生成67.2L气体M
|
|
| 7. 单选题 | |
|
室温下,体积均为20mL、浓度均为0.1mol·L-1的HX溶液、HY溶液中分别滴加同浓度的NaOH溶液,反应后溶液中水电离的c(H+)水的负对数[–lgc(H+)水]与滴加氢氧化钠溶液体积的关系如图所示。下列说法正确的是( )
A . 室温时,Ka(HX)=10-6
B . a、b、c三点溶液均显中性
C . b、d两点溶液的离子总浓度不同
D . c点溶液中c(X-)+c(HX)=0.1mol·L-1
|
|
| 8. 实验探究题 | |
|
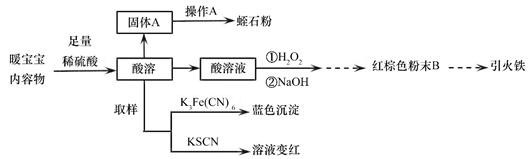
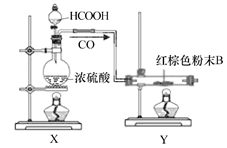
蛭石是一种铝硅酸盐(不溶于稀酸、碱),加热后体积会增大为原体积的60倍,具有理想的保温及涵水功能,是种植业的优良基质材料。一种“暖宝宝”内充Fe粉、蛭石粉、活性炭、NaCl固体和吸水性树脂,使用时去掉不透气的外包装使透气内袋暴露在空气中,即可发热至53℃左右。某化学兴趣小组设计了以下实验,探究已使用过的“暖宝宝”成分、回收蛭石,并制备“引火铁”(一种抛撒到空气中即可自燃的超细铁粉)。
(实验方案) (实验装置)(制引火铁) 回答下列问题:
|
|
| 9. 综合题 | |
|
碳酸镍是制备合成纳米镍的一种前驱体。以镍废渣(主要成分为Ni,含少量Fe、Al、Fe3O4、Al2O3和不溶性杂质等)为原料获得碳酸镍流程如图:
回答下列问题:
|
|
| 10. 综合题 | |
|
高纯度的氢氟酸是制造芯片的重要原料之一。
|
|
高中化学 试卷推荐
- 备考2018年高考化学一轮基础复习:专题8 铁及其化合物
- 天津市南开中学2020年高考化学一模试卷
- 2015-2016学年陕西省延安市黄陵中学高二下学期期中化学试卷
- 2016-2017学年河南省南阳市方城一中高二上学期开学化学试卷
- 高化人教新版必修1第一章 1 物质的分类及转化(1)物质的分类同步训练
- 2015-2016学年辽宁省锦州市高二下学期期末化学试卷
- 广东省汕头市金山中学2019-2020学年高二下学期化学6月月考试卷
- 2016-2017学年贵州省黔南州都匀一中高二上学期开学化学试卷
- 人教版高中化学选修五 第四章第三节:蛋白质和核酸
- 四川省内江市威远县自强中学2015-2016学年高三上学期化学期中考试试卷
- 高中化学鲁科版(2019)选择性必修2 第2章第3节 离子健、配位键与金属键
- 湖北省荆州市部分区县2019-2020学年高一上学期化学期末考试试卷
最近更新





 )+c(HCO
)+c(HCO  )+c(H2CO3)
)+c(H2CO3)






