云南省昆明市2017-2018学年高考理综-化学3月模拟考试试卷
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
化学与生产、生活密切相关。下列说法错误的是( )
A . 利用硅材料可制成光伏发电装置
B . SO2、漂白液、双氧水的漂白原理相同
C . 使用无磷洗涤剂可减少水华的发生
D . 催化净化汽车尾气可降低污染
|
|
| 2. 单选题 | |
|
下列说法正确的是( )
A . C4H9Cl有4种同分异构体
B . 乙醇的沸点比乙烷的沸点低
C . 糖类、油脂和蛋白质都能发生水解反应
D . 石油分馏可以得到丙烯等重要化工基本原料
|
|
| 3. 单选题 | ||||||||||||||||
|
下列实验操作能达到目的的是( )
A . A
B . B
C . C
D . D
|
||||||||||||||||
| 4. 单选题 | |
|
最近全球多个国家爆发大规模流感,中药良好的预防和治疗作用再次进入科学家的视野。食用香料肉桂具有良好的预防作用,其有效成分之一肉桂酸结构简式如图所示。下列说法错误的是( )
A . 肉桂酸的化学式为C9H8O2
B . 肉桂酸能发生加成反应、取代反应
C . 肉桂酸的结构中含有4个碳碳双键
D . 肉桂酸能使溴水、酸性高锰酸钾溶液褪色
|
|
| 5. 单选题 | |
|
W、X、Y、Z是原子序数依次增大的短周期主族元素,W是地壳中含量最多的元素,X和Z原子最外层电子数相同,Z的原子半径是同周期主族元素中最小的,Y原子的核电荷数是周期数的4倍。下列说法正确的是( )
A . 氢化物的沸点:X<Z
B . 简单离子半径:W>Z>X>Y
C . Y单质着火可用泡沫灭火器灭火
D . X单质可从W的简单氢化物中置换出W单质
|
|
| 6. 单选题 | |
|
有机酸种类繁多,甲酸( HCOOH)是常见的一元酸,常温下其Ka=1.8×10-4 , 草酸(H2C2O4)是常见的二元酸,常温下,Ka1=5.4×10-2 , Ka2=5.4×10-5。下列说法正确的是( )
A . 甲酸钠溶液中:c(Na+)>c(HCOOˉ)>c(H+)>c(OHˉ)
B . 草酸氢钠溶液中加入甲酸钠溶液至中性:c(Na+)=c(HC2O4ˉ)+2c(C2O42-)+c(HCOOˉ)
C . Na2C2O4溶液中;c(HC2O4ˉ)+c(H2C2O4)+c(H+)=c(OHˉ)
D . 足量甲酸与草酸钠溶液反应:2 HCOOH+Na2C2O4=H2C2O4+2 HCOONa
|
|
| 7. 实验探究题 | ||||||||||||||||
|
某化工厂排放的工业废水中主要含Na+、HSO3ˉ、SO42- , 研究小组欲测定其中HSO3ˉ的浓度,设计如下三个方案。
量取20.00mL废水试样,用0.02moL·K-1MnO4标准溶液进行滴定。记录数据,计算。 回答下列问题
|
||||||||||||||||
| 8. 综合题 | |
|
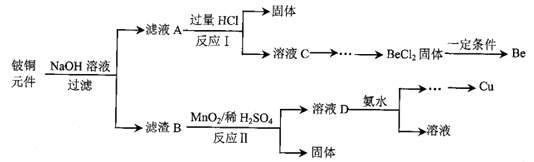
铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铍铜元件(含BeO25%、CuS71%、少量FeS和SiO2)中回收铍和铜两种金属的流程
已知:I.铍、铝元素处于周期表中的对角线位置,化学性质相似 Ⅱ.常温下: Ksp[Cu(OH)2]=2.2×10-20 Ksp[Fe(OH)3]=4.0×10-38 K sp[Mn(OH)2]=2.1×10-13
|
|
| 9. 综合题 | |||||||||||
|
氯气及其化合物在生产生活中有重要的应用。
|
|||||||||||
| 10. 综合题 | |
|
CuCl广泛应用于有机合成催化。例如
 ,回答下列问题: ,回答下列问题:
|
|



 CH2=CHCH2Cl(g)+HCl(g)。一定压强下,该反应在不同温度、不同投料比时,达平衡时Cl2的转化率如图所示(T12< T3)
CH2=CHCH2Cl(g)+HCl(g)。一定压强下,该反应在不同温度、不同投料比时,达平衡时Cl2的转化率如图所示(T12< T3)
 ,K值将 (填“增大”“减小”或“不变”);若起始时向该容器中充入0.30mol丙烯、0.20 molCl2、0.15 mol CH2=CHCH2Cl和0.30 molHCl,判断反应进行的方向并说明理由。
,K值将 (填“增大”“减小”或“不变”);若起始时向该容器中充入0.30mol丙烯、0.20 molCl2、0.15 mol CH2=CHCH2Cl和0.30 molHCl,判断反应进行的方向并说明理由。



