河南省商丘市2022届高三下学期第三次模拟考试化学试题
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
化学与生产、生活密切相关。下列说法正确的是( )
A . 焊接金属时,焊接点可用NH4Cl溶液进行预处理
B . 环保PVC(聚氯乙烯)可以制作食品包装袋、食品保鲜膜
C . 烟熏腊肉中含有丰富的脂肪,脂肪属于天然高分子化合物
D . 工业上,常用氯气处理水中的Cu2+、Hg2+等重金属离子
|
|
| 2. 单选题 | ||||||||||||||||
|
下列气体去除杂质的方法中,达不到实验目的的是( )
A . A
B . B
C . C
D . D
|
||||||||||||||||
| 3. 单选题 | |
|
下列过程中的化学反应,相应的离子方程式正确的是( )
A . FeCl3溶液腐蚀印刷电路板上的铜:Fe3++Cu=Fe2++Cu2+
B . 将Al2(SO4)3溶液与Na2CO3溶液混合:2Al3++3CO
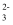 =Al2(CO3)3
C . 用稀HNO3溶解FeS固体:FeS+2H+=Fe2++H2S↑
D . 向Mg(OH)2悬浊液中滴加NH4Cl溶液,沉淀逐渐解:Mg(OH)2 +2NH =Al2(CO3)3
C . 用稀HNO3溶解FeS固体:FeS+2H+=Fe2++H2S↑
D . 向Mg(OH)2悬浊液中滴加NH4Cl溶液,沉淀逐渐解:Mg(OH)2 +2NH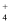 =Mg2++2NH3•H2O =Mg2++2NH3•H2O
|
|
| 4. 单选题 | |
|
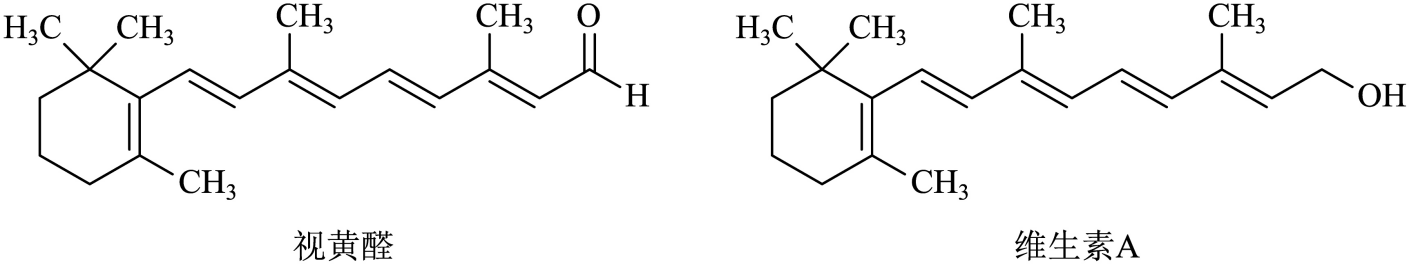
长时间看电子显示屏幕,会对眼睛有一定的伤害。人眼的视色素中含有视黄醛,而与视黄醛结构相似的维生素A常作为保健药物。下列有关叙述正确的是( )
A . 视黄醛的分子式为C20H26O
B . 视黄醛与乙醛(CH3CHO)互为同系物
C . 一定条件下,维生素A可被氧化生成视黄醛
D . 视黄醛和维生素A互为同分异构体
|
|
| 5. 单选题 | |
|
某化合物可用作发酵助剂,结构如图所示。图中X、Y、Z、W为元素周期表中前20号元素,且位于不同周期,它们的原子序数依次增大,其中Y为地壳中含量最高的元素。下列有关说法正确的是( )
A . 该化合物中除X外,其他原子最外层不一定均为8
 B . Z元素形成的单质均为白色固体
C . X分别与Y、Z、W形成的简单化合物中均含有共价键
D . Z的最高价氧化物的水化物的酸性强于硫酸
B . Z元素形成的单质均为白色固体
C . X分别与Y、Z、W形成的简单化合物中均含有共价键
D . Z的最高价氧化物的水化物的酸性强于硫酸
|
|
| 6. 单选题 | |
|
某科研团队研制了一种基于阳离子型活性分子的中性水系有机液流电池,以[Pyr-TEMPO]和[Pyr-PV]Cl4作中性水系有机液流电池的电极材料,已知放电时[Pyr-PV]2+先转化为[Pyr-PV]3+ , 后转化为[Pyr-PV]4+ , 电池工作原理如图所示。下列说法正确的是( )
A . 放电的过程中,氯离子由b电极向a电极移动
B . 放电时,负极的电极反应之一为[Pyr-PV]3+-
 =[Pyr-PV]4+
C . a电极的电势比b电极的低
D . 充电时,b电极为阳极,发生氧化反应 =[Pyr-PV]4+
C . a电极的电势比b电极的低
D . 充电时,b电极为阳极,发生氧化反应
|
|
| 7. 单选题 | |
|
用0.10
 的NaOH溶液分别滴定20.00mL浓度为c1的醋酸、c2的草酸(H2C2O4)溶液,得到如图滴定曲线,其中c、d为两种酸恰好完全中和的化学计量点。下列说法错误的是( ) 的NaOH溶液分别滴定20.00mL浓度为c1的醋酸、c2的草酸(H2C2O4)溶液,得到如图滴定曲线,其中c、d为两种酸恰好完全中和的化学计量点。下列说法错误的是( )
A . 由滴定曲线可判断:c1>c2
B . 滴定过程中始终有n(CH3COOH)=0.02c1+n(OH-)-n(H+)-n(Na+)
C . 若a点V(NaOH)=7.95 mL,则a点有c(Na+)>c(C2O
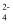 )>c(HC2O )>c(HC2O )>c(H2C2O4)
D . 若b点时溶液中c(CHCOO-)=c(CHCOOH),则b点消耗了8.60mL的NaOH溶液 )>c(H2C2O4)
D . 若b点时溶液中c(CHCOO-)=c(CHCOOH),则b点消耗了8.60mL的NaOH溶液
|
|
| 8. 综合题 | |
|
三氧化二砷(As2O3)可用于治疗急性早幼粒细胞白血病。利用某酸性含砷废水(含H3AsO3、H2SO4)可提取As2O3 , 提取工艺流程如下:
已知:①As2O3为酸性氧化物;②As2S3易溶于过量的Na2S溶液中,故加入FeSO4 , 的目的是除去过量的S2-。 回答下列问题:
|
|
| 9. 实验探究题 | |||||||||||||||||
|
六氨合氯化镁(MgCl2•6NH3)具有极好的可逆吸、放氨特性,是一种优良的储氨材料。某研究小组以MgCl2•6H2O为原料在实验室制备MgCl2•6NH3 , 并测定所得产品中氯的含量
|
|||||||||||||||||
| 10. 综合题 | |
|
环保是当今社会最重要的课题,故研究CO、NOx、SO2等大气污染物的妥善处理具有重义。回答下列问题
|
|
- 湖南省湘西州2019年化学高考模拟试卷
- 2017年宁夏银川市长庆高级中学高考化学一模试卷
- 备考2020年高考化学二轮专题 18 有机实验综合
- 河北省衡水市衡水中学2017-2018学年高考理综-化学第三十六次模拟考试试卷
- 江苏省无锡市江阴市四校艺术班2017-2018学年高一上学期化学期中考试试卷
- 河北省承德市围场卉原中学2020年高考理综-化学模拟试卷
- 2016年江苏省淮安市高考化学三模试卷
- 辽宁省葫芦岛市2019-2020学年高二下学期化学期末考试试卷
- 广西自治区来宾市2020年高考理综-化学4月模拟试卷
- 人教版化学高二选修5第一章第三节有机化合物的命名同步练习
- 第18讲:化学反应速率及其影响因素
- 2015-2016学年北京市西城区普通中学高一下学期期末化学模拟试卷




 +2H++2I-=AsO
+2H++2I-=AsO +I2+H2O。探究pH对AsO
+I2+H2O。探究pH对AsO
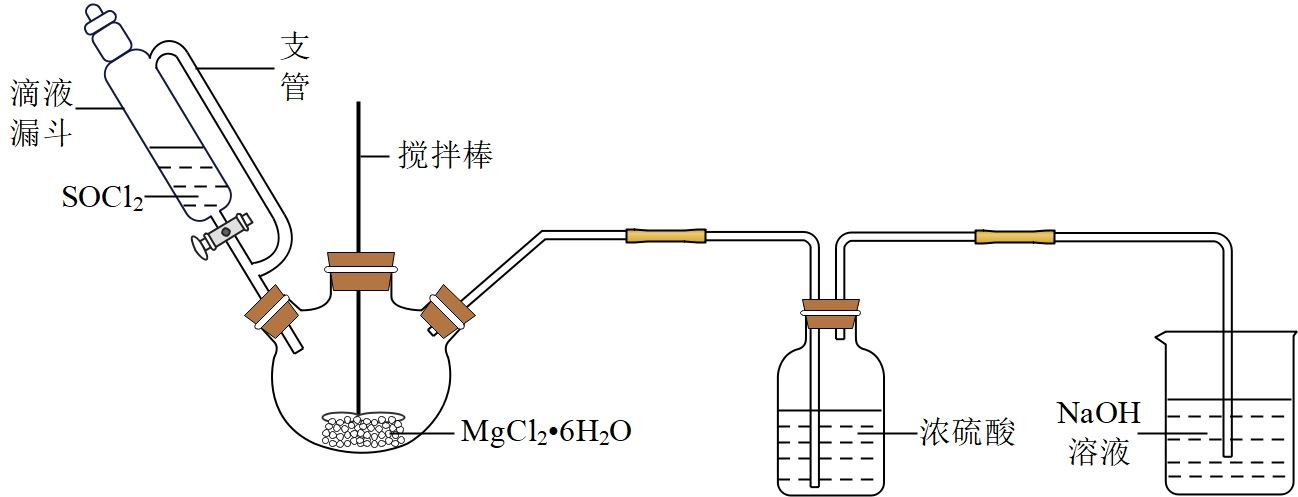
 105℃、沸点76℃;遇水剧烈水解生成两种酸性气体。
105℃、沸点76℃;遇水剧烈水解生成两种酸性气体。 )后,过滤、洗涤并自然风干,制得粗品。相关物质的性质如表:
)后,过滤、洗涤并自然风干,制得粗品。相关物质的性质如表:
 , 记录消耗标准液的体积;
, 记录消耗标准液的体积;
 达到平衡的是(填字母)。
达到平衡的是(填字母)。



