贵州省安顺市2017-2018学年高考理综-化学三模考试试卷
贵州省安顺市2017-2018学年高考理综-化学三模考试试卷
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
化学与生产、生活息息相关。下列叙述错误的是( )
A . 焊接金属时常用NH4Cl溶液做除锈剂
B . 聚丙烯可用于制造汽车保险杠
C . 双氧水和酒精均可用于消毒杀菌,但原理不相同
D . 普通泡沫灭火器的内筒和外筒均使用钢作材质
|
|
| 2. 单选题 | |
|
下列化学用语正确的是( )
A . 环氧乙烷的结构简式为
|
|
| 3. 单选题 | |
|
a、b、c、d为原子半径依次增大的四种短周期主族元素,其中元素a的最高正价与最低负价的代数和等于0,b、c能形成摩尔质量相同的两种单质,b、d则能化合成淡黄色的固体。下列有关判断错误的是( )
A . 核电荷数大小:c>d>b>a
B . 简单氢化物的热稳定性:b>c
C . b能分别与a、c、d形成具有漂白性的物质
D . c与a形成的化合物分子中,各原子均达到8电子稳定结构
|
|
| 4. 单选题 | |
|
用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A . 标准状况下,33.6L氦气所含的原子数目是3NA
B . 2.2gKHCO3与Mg3N2的混合物中含有的质子数目为1.1NA
C . 0.3molNaHSO4固体在熔融状态下所含的SO42-数目为0.3NA
D . 25℃时,1LpH=12的Na2CO3溶液中含有Na+的数目为0.02NA
|
|
| 5. 单选题 | |||||||||||||||||||||
|
下列实验操作所对应的现象以及结论都正确的是( )
A . A
B . B
C . C
D . D
|
|||||||||||||||||||||
| 6. 单选题 | |
|
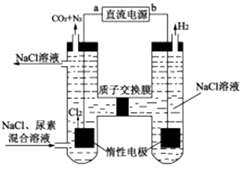
人工肾脏可用电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图所示。下列有关说法错误的是( )
A . a为直流电源的正极
B . 阳极室中发生的电极反应式有2Cl--2e-=Cl2↑
C . 电解结束后,阴极室溶液的pH将降低
D . 若两极共收集到气体13.44L(标准状况),混合溶液可除去尿素7.2g(忽略气体的溶解)
|
|
| 7. 单选题 | |
|
已知常温时HClO的Ka=3.0×10-8 , HF的Ka=3.5×10-4。现将pH和体积都相同的次氯酸和氢氟酸溶液分别加蒸馏水稀释,pH随溶液体积的变化如图所示。下列叙述正确的是( )
A . 曲线I为次氯酸稀释时pH变化曲线
B . 取a点的两种酸溶液,中和相同体积、相同浓度的NaOH溶液,消耗次氯酸的体积较小
C . a点时,若都加入相同大小的锌粒,此时与氢氟酸反应的速率大
D . b点溶液中水的电离程度比c点溶液中水的电离程度小
|
|
| 8. 综合题 | |
|
氮氧化合物是目前造成大气污染的主要气体,而汽车尾气中就含有NO 等多种污染气体。汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致。请结合所学知识回答下列问题:
|
|
| 9. 综合题 | |
|
钾长石(K2Al2Si6O16)通常也称正长石,主要用于生产玻璃、陶瓷制品,还可用于制取钾肥。某学习小组以钾长石为主要原料,从中提取氧化铝、碳酸钾等物质,工艺流程如下:
回答以下问题:
|
|
| 10. 综合题 | |
|
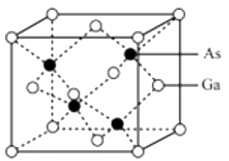
氮、磷、砷是第VA族的元素,它们的单质及其化合物在生产生活中均有重要作用。请回答以下问题:
|
|
高中化学 试卷推荐
- 浙江省湖州市2019-2020学年高二下学期化学期末考试试卷
- 江西省南昌市2018-2019学年高考化学二模考试试卷
- 广东省佛山市2017-2018学年高二上学期化学期末考试试卷
- 2018年高考化学真题分类汇编专题15:物质的制备
- 山东省威海市2019-2020学年高一下学期化学期末考试试卷
- 2016年上海市静安区高考化学一模试卷
- 广西省钦州市钦州港经济技术开发区2016-2017学年高二下学期化学期末考试试卷
- 高中化学人教版(2019)必修第二册 第六章第一节 化学反应与能量变化
- 2015-2016学年福建省岐滨中学高三上学期开学化学试卷
- 宁夏吴忠市吴忠中学2017-2018学年高一上学期化学期末模拟试卷
- 福建省厦门市2018-2019学年高考化学二模考试试卷
- 河南省郑州市2016-2017学年高二下学期化学期末考试试卷
最近更新

 2NO2(g) △H1=+67.8 kJ/mol
2NO2(g) △H1=+67.8 kJ/mol