2022年高考理综化学真题试卷(全国甲卷)
2022年高考理综化学真题试卷(全国甲卷)
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
化学与生活密切相关。下列叙述正确的是( )
A . 漂白粉与盐酸可混合使用以提高消毒效果
B . 温室气体是形成酸雨的主要物质
C . 棉花、麻和蚕丝均为碳水化合物
D . 干冰可用在舞台上制造“云雾”
|
|
| 2. 单选题 | |
|
辅酶
 具有预防动脉硬化的功效,其结构简式如下。下列有关辅酶 具有预防动脉硬化的功效,其结构简式如下。下列有关辅酶 的说法正确的是( ) 的说法正确的是( )
A . 分子式为
 B . 分子中含有14个甲基
C . 分子中的四个氧原子不在同一平面
D . 可发生加成反应,不能发生取代反应
B . 分子中含有14个甲基
C . 分子中的四个氧原子不在同一平面
D . 可发生加成反应,不能发生取代反应
|
|
| 3. 单选题 | |
|
能正确表示下列反应的离子方程式为( )
A . 硫化钠溶液和硝酸混合:
 B . 明矾溶液与过量氨水湿合:
B . 明矾溶液与过量氨水湿合: C . 硅酸钠溶液中通入二氧化碳:
C . 硅酸钠溶液中通入二氧化碳: D . 将等物质的量浓度的
D . 将等物质的量浓度的 和 和 溶液以体积比1∶2混合: 溶液以体积比1∶2混合:
|
|
| 4. 单选题 | |
|
一种水性电解液
 离子选泽双隔膜电池如图所示(KOH溶液中, 离子选泽双隔膜电池如图所示(KOH溶液中, 以 以 存在).电池放电时,下列叙述错误的是( ) 存在).电池放电时,下列叙述错误的是( )
A . Ⅱ区的
 通过隔膜向Ⅲ区迁移
B . Ⅰ区的 通过隔膜向Ⅲ区迁移
B . Ⅰ区的 通过隔膜向Ⅱ区迁移
C . 通过隔膜向Ⅱ区迁移
C . 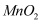 电极反应: 电极反应: D . 电池总反应:
D . 电池总反应:
|
|
| 5. 单选题 | |
 为阿伏加德罗常数的值,下列说法正确的是( ) 为阿伏加德罗常数的值,下列说法正确的是( )
A .
 , ,  下, 下, 氢气中质子的数目为 氢气中质子的数目为 B .
B .  溶液中, 溶液中, 的数目为 的数目为 C .
C .  苯甲酸完全燃烧,生成 苯甲酸完全燃烧,生成 的数目为 的数目为 D . 电解熔融
D . 电解熔融 , 阴极增重 , 阴极增重 , 外电路中通过电子的数目为 , 外电路中通过电子的数目为
|
|
| 6. 单选题 | |
|
Q,X、Y,Z是原子序数依次增大的短周期主族元素,其最外层电子数之和为19.Q与X、Y、Z位于不同周期,X、Y相邻,Y原子最外层电子数是Q原子内层电子数的2倍。下列说法正确的是( )
A . 非金属性:X>Q
B . 单质的熔点:X>Y
C . 简单氢化物的佛点:Z>Q
D . 最高价含氧酸的酸性:Z>Y
|
|
| 7. 单选题 | |||||||||||||||||||||
|
根据实验目的,下列实验及现象、结论都正确的是( )
A . A
B . B
C . C
D . D
|
|||||||||||||||||||||
| 8. 综合题 | |||||||||||||
|
硫酸锌(
 )是制备各种含锌材料的原料,在防腐、电镀、医学上有诸多应用.硫酸锌可由菱锌矿制备.菱锌矿的主要成分为 )是制备各种含锌材料的原料,在防腐、电镀、医学上有诸多应用.硫酸锌可由菱锌矿制备.菱锌矿的主要成分为 , 杂质为 , 杂质为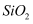 以及 以及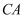 、 、 、 、 、 、 等的化合物.其制备流程如下: 等的化合物.其制备流程如下:
本题中所涉及离子的氯氧化物溶度积常数如下表:
回答下列问题:
|
|||||||||||||
| 9. 综合题 | |
|
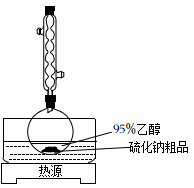
硫化钠可广泛用于染料、医药行业.工业生产的硫化钠粗品中常含有一定量的煤灰及重金属硫化物等杂质.硫化钠易溶于热乙醇,重金属硫化物难溶于乙醇。实验室中常用95%乙醇重结晶纯化硫化钠粗品。回答下列向题:
|
|
| 10. 综合题 | |
|
金属钛(
 )在航空航天、医疗器械等工业领域有着重要用途,目前生产钛的方法之一是将金红石 )在航空航天、医疗器械等工业领域有着重要用途,目前生产钛的方法之一是将金红石 转化为 转化为 , 再进一步还原得到钛。回答下列问题: , 再进一步还原得到钛。回答下列问题:
|
|
高中化学 试卷推荐
- 广西壮族自治区田阳高中2018-2019学年高二上学期化学11月月考试卷
- 高中化学人教版(2019)必修第二册 第八章第二节 化学品的合理使用
- 高中化学人教版(新课标)选修4 第一章第二节 燃烧热 能源
- 上海市浦东新区2018-2019学年高二上学期化学期末考试试卷
- 2017-2018学年人教版高中化学选修五第一章 第四节 研究有机化合物的一般步骤和方法
- 江苏省泰州市2019-2020学年高一下学期化学期末考试试卷
- 备考2020年高考化学二轮专题 04 离子共存
- 2015-2016学年湖南省娄底市湘中名校高二上学期期末化学试卷(理科)
- 湖北省荆州市四县市2019-2020学年高二上学期化学期末考试试卷
- 2016-2017学年安徽省芜湖市高二上学期期末化学试卷(理科)
- 广东省肇庆市2017-2018学年高三理综-化学第二次模拟考试试卷
- 2016-2017学年甘肃省天水市秦安县郭嘉中学高一上学期期中化学试卷
最近更新


 和
和 的水解常数
的水解常数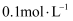 的
的 和
和 溶液的
溶液的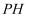 , 后者大于前者
, 后者大于前者
 溶液,紫色褪去
溶液,紫色褪去 、
、 相互转化的影响
相互转化的影响 溶液中缓慢滴加硫酸,黄色变为橙红色
溶液中缓慢滴加硫酸,黄色变为橙红色


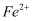







 B.
B. C.
C.
 的滤液①中分批加入适量
的滤液①中分批加入适量 反应可以释放
反应可以释放 并循环利用,同时得到的副产物是、。
并循环利用,同时得到的副产物是、。
 )和煤粉在高温下生产硫化钠,同时生成
)和煤粉在高温下生产硫化钠,同时生成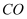 , 该反应的化学方程式为。
, 该反应的化学方程式为。
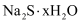 。
。
 转化为
转化为 时反应的热化学方程式及其平衡常数如下:
时反应的热化学方程式及其平衡常数如下:

 ①反应
①反应 的
的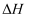 为
为 ,
, 
 。
。 , 将
, 将 以物质的量比1∶2.2∶2进行反应.体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
以物质的量比1∶2.2∶2进行反应.体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。

 的平衡常数
的平衡常数
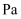 。
。 平衡时
平衡时 几乎完全转化为
几乎完全转化为 , 但实际生产中反应温度却远高于此温度,其原因是。
, 但实际生产中反应温度却远高于此温度,其原因是。 “固—固”接触的措施是。
“固—固”接触的措施是。



