四川省雅安市2022届高三下学期第三次诊断性考试理综化学试题
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
化学与科技、生产、生活有密切的关系。下列叙述中错误的是( )
A . “天和核心舱”电推进系统腔体采用的氮化硼陶瓷属于新型无机非金属材料
B . 华为自主研发的“麒麟”芯片与太阳能电池感光板所用材料均为晶体硅
C . 二氧化碳合成淀粉过程中未涉及碳碳键的形成
D . 2022 年北京冬奥会火炬“飞扬”以氢气为燃料,对环境友好无污染
|
|
| 2. 单选题 | |
|
NA为阿伏加德罗常数的值。下列叙述正确的是( )
A . 24g金刚石中含有的共价键数目为8 NA
B . 分别用Na2O2和KMnO4制取1.0mol氧气,转移电子数目均为4NA
C . 0.1mol/L 的NaHCO3溶液中,
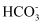 的数目一定小于0.1 NA
D . 密闭容器中,1.0mol H2和1.0mol I2充分反应后分子总数为2 NA 的数目一定小于0.1 NA
D . 密闭容器中,1.0mol H2和1.0mol I2充分反应后分子总数为2 NA
|
|
| 3. 单选题 | ||||||||||||||||
|
下列操作与现象、结论均正确的是( )
A . A
B . B
C . C
D . D
|
||||||||||||||||
| 4. 单选题 | |
|
从天然艾叶可以提取香芹醇,其结构简式如图所示。下列关于香芹醇的叙述错误的是( )
A . 香芹醇分子的所有碳原子处于同一平面内
B . 1mol 香芹醇可与1mol 金属钠反应
C . 香芹醇可以跟Br2/CCl4 发生加成反应
D . 香芹醇的分子式是C10H16O
|
|
| 5. 单选题 | |
|
硬水除垢可以让循环冷却水系统稳定运行。某科研团队改进了主动式电化学硬水处理技术,原理如图 (R表示有机物)所示。下列说法错误的是( )
A . a端为电源正极,处理后的水垢沉积在阴极底部
B . 处理过程中Cl-可以循环利用
C . 铂电极M发生的电极反应式:2Cl- +2e- =Cl2↑; 2H2O+4e- =O2↑+4H+
D . 铂电极M处产生的H+移向铂电极N
|
|
| 6. 单选题 | |
|
一种由短周期元素组成的化合物,其结构如下图所示。X、Y、Z、Q、R位于同一周期,且原子序数依次递增,Z、Q的核电荷数之和等于R的最外层电子数的2倍。下列判断错误的是( )
A . 离子半径: X<R<Q
B . 使用ZQ2跨临界可直接制冰,利用了ZQ2晶体易升华的性质
C . 元素的非金属性: Z<Q<R
D . 化合物YR3中各原子最外层均满足8电子稳定结构
|
|
| 7. 单选题 | |
|
常温下,向10mL 0.1mol/L的HNO2溶液中逐滴加入一定浓度的氨水,不考虑NH4NO2的分解,所得溶pH及导电能力变化如下图。下列分析正确的是( )
A . 氨水的物质的量浓度约为0.05mol/L
B . b点溶液中离子浓度大小的关系: c(
 )>c( )>c( )>c(H+)>c(OH -)
C . a、d两点的导电能力和pH都相同
D . a点和b点溶液中,水的电离程度大小是a>b )>c(H+)>c(OH -)
C . a、d两点的导电能力和pH都相同
D . a点和b点溶液中,水的电离程度大小是a>b
|
|
| 8. 实验探究题 | |
|
环己酮(
|
|
| 9. 综合题 | |
|
气态含氮化合物及相关反应是新型科研热点。
|
|
| 10. 综合题 | |||||||||||||||
|
氯化亚钴在国防工业、仪器制造、畜牧业等领域中发挥着重要的作用。利用钴废料(主要成分为Co2O3 , 含少量Fe2O3、Al2O3、MnO、MgO、CaO、碳及有机物等)制取CoCl2·6H2O粗品的工艺流程如下:
已知:①浸出液中含有的阳离子有H+、Co2+、 Fe2+、 Mn2+、 Ca2+、Mg2+、Al3+等。 ②部分阳离子以氢氧化物形式完全沉淀时的pH如下表:
|
|||||||||||||||





 4NO(g)+6H2O(g ) △H1
4NO(g)+6H2O(g ) △H1
 减小,可能的原因是。
减小,可能的原因是。
 进行反应,平衡时某反应物的转化率和氮氯比及不同温度的关系如图所示:
进行反应,平衡时某反应物的转化率和氮氯比及不同温度的关系如图所示:






