高中化学人教版(2019)选择性必修1第二章第三节第四节(两节合一)
教材版本:化学
试卷分类:化学高二上学期
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 填空题 | |||||||||||||
|
根据所学的知识和经验,判断下列变化在常温下的焓变、熵变及方向性,填表:
(说明:△H、△S填“>0”、“<0”、“=”,方向性填“可以自发”、“不能自发”或“无法确定”) |
|||||||||||||
| 2. 综合题 | |
|
氨是重要的无机化工产品,合成氨工业对国民经济和社会发展具有重要的意义。其原理如下:N2(g)+3H2(g)
 2NH3 (g) ΔH< 0。在恒温恒容密闭容器中进行合成氨反应,各组分浓度与时间的关系如图所示。 2NH3 (g) ΔH< 0。在恒温恒容密闭容器中进行合成氨反应,各组分浓度与时间的关系如图所示。
|
|
| 3. 填空题 | |
|
已知2CO(g)
 CO2(g)+C(s),T=980k时,△H-TΔS=O。当体系温度低于980k时.估计△H-T△S的正负符号为,所以正反应进行(填“自发”或“非自发”);当体系温度高于980k时.△H-T△S的正负符号为。 在冶金工业中,以C作为还原剂温度高于980k时的氧化物是以为主,低于980k时以为主。 CO2(g)+C(s),T=980k时,△H-TΔS=O。当体系温度低于980k时.估计△H-T△S的正负符号为,所以正反应进行(填“自发”或“非自发”);当体系温度高于980k时.△H-T△S的正负符号为。 在冶金工业中,以C作为还原剂温度高于980k时的氧化物是以为主,低于980k时以为主。
|
|
| 4. 单选题 | |
|
下列工业生产所采取的措施和其对应目的不一致的是( )
A . 合成氨工业采用高压条件,目的是加大反应速率并促进平衡向合成氨的方向移动
B . 接触法制硫酸中,使用热交换器的目的是充分利用能源
C .
 氧化为 氧化为  时需使用催化剂,这样是为了提高 时需使用催化剂,这样是为了提高  的转化率
D . 用氨水吸收硫酸的尾气,目的是保护环境且能够得到化肥 的转化率
D . 用氨水吸收硫酸的尾气,目的是保护环境且能够得到化肥
|
|
| 5. 单选题 | |
|
下列说法错误的是( )
A .
 该反应的 该反应的 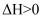 , ,  ,在低温下,该反应不能自发进行
B . ,在低温下,该反应不能自发进行
B .  该反应的 该反应的  , ,  ,在低温下能自发进行
C . ,在低温下能自发进行
C . 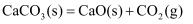 该反应的 该反应的 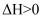 , ,  ,在低温下,该反应能自发进行
D . ,在低温下,该反应能自发进行
D .  该反应的 该反应的 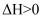 , ,  ,在高温下,该反应能自发进行 ,在高温下,该反应能自发进行
|
|
| 6. 填空题 | |
|
在 2020 年中央经济工作会议上,我国明确提出“碳达峰”与“碳中和”目标,因此利用煤炭或CO 2 合成其它高价值化学品的工业生产显得更加重要。
|
|
| 7. 单选题 | |
|
下列说法正确的是( )
A . 在合成氨工业中,移走NH3可增大正反应速率,提高原料转化率
B . 恒温下进行的反应
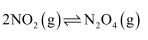 达平衡时,缩小容器体积再达平衡时,气体的颜色比第一次平衡时的深,NO2的体积分数比原平衡大
C . 常温下, 达平衡时,缩小容器体积再达平衡时,气体的颜色比第一次平衡时的深,NO2的体积分数比原平衡大
C . 常温下,  不能自发进行,则其 不能自发进行,则其 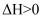 D . 在相同温度下,物质的量浓度相等的氨水、NaOH溶液,c(OH-)相等
D . 在相同温度下,物质的量浓度相等的氨水、NaOH溶液,c(OH-)相等
|
|
| 8. 单选题 | |
|
某反应只有在高温下才具有自发性,则对该反应的△H和△S判断正确的是( )
A . △H>0、△S>0
B . △H<0、△S<0
C . △H>0、△S<0
D . △H<0、△S>0
|
|
| 9. 单选题 | |
|
关于合成氨工业的说法错误的是( )
A . 合成氨工业采用循环操作,主要是为了提高氮气和氢气的利用率
B . 工业上一般选择400-500℃的主要原因是让铁触媒的活性大,反应速率快
C . 从合成氨的原理出发,增大压强既有利于加快速率又有利于平衡右移,但压强增大设备成本大幅度提升,所以实际工业中往往采用常压
D . 为了防止催化剂“中毒”,原料气需要经过净化
|
|
| 10. 单选题 | |
|
研究表明,在等温、等压及除了体积功以外不做其他功的条件下,化学反应的方向可以用反应的焓变和熵变来综合判断,判据为ΔH-TΔS。任何温度下都能正向自发进行的一项是( )
A . CH4(g) = C(s) +2H2(g) ΔH=+74.8 kJ·mol-1 ΔS=+80.7 J·mol-1·K-1
B . C2H2(g)+3H2(g)= 2CH4(g) ΔH=-376.4 kJ·mol-1 ΔS=-220.2J·mol-1·K-1
C . 2CO(g)=2C(s,石墨)+O2(g) ΔH=+221.0 kJ·mol-1 ΔS=-178.8J·mol-1·K-1
D . 2KClO3(s)=2KCl(s)+3O2(g) ΔH=-78.0 kJ·mol-1 ΔS=+494.4J·mol-1·K-1
|
|
- 第7讲:铁及其化合物
- 2016-2017学年辽宁省葫芦岛市六校协作体高一上学期期中化学试卷
- 2015-2016学年陕西省汉中市汉台中学高一下学期期中化学试卷
- 备考2018年高考化学二轮专题复习 综合复习:有机化学
- 山西运城市2020年高考化学一模试卷
- 2020年山东省高考化学试卷(新高考I)
- 人教版化学高二选修6第四单元实验4-3含氯消毒液性质、作用的探究同步练习
- 浙江省衢州市2019-2020学年高一下学期化学期末考试试卷
- 2015-2016学年四川省眉山中学高二下学期期中化学试卷
- 2017_2018学年高中化学人教版选修四 第四章电化学基础4.3.1电解池
- 2015-2016学年河北省邯郸市曲周一中高二下学期期末化学试卷
- 山东省烟台市2017-2018学年高一下学期化学期末考试试卷

 ΔH2=-571kJ mol−1
ΔH2=-571kJ mol−1 CO2(g)+2H2(g)的 ΔH = 。
CO2(g)+2H2(g)的 ΔH = 。



