第2章 酸与碱 知识点题库
小科在碳酸钠溶液中滴加氯化钙溶液,产生白色沉淀,然后再滴入适量经过稀释的硫酸溶液。该实验过程的操作如图所示,下列有关操作与目的分析均正确的是( )

选项 | 物质(括号内为杂质) | 除去杂质的方法 |
A | NaOH溶液 (Na2CO3) | 加入适量的Ca(OH)2溶液、过滤 |
B | CaO(CaCO3) | 加水溶解、过滤 |
C | CO(CO2) | 通过足量的NaOH溶液、干燥 |
D | FeSO4溶液(H2SO4) | 加入足量Fe粉、过滤 |
酸溶液和碱溶液混合会发生怎样的变化呢?某班级同学开展如图1所示相关的实验.下面是两个小组的实验
记录与分析.请根据要求回答问题:

-
(1) 甲组同学往一定体积10%的氢氧化钠溶液样品中滴加10%的盐酸(室温下),反应中溶液温度的变化记录如下:
加入盐酸的体积(V)/mL
2
4
6
8
10
12
14
16
18
20
溶液温度上升
(△t)/℃
5.6
9.8
12.1
16.3
18.5
17.1
15.2
14.6
13.5
12.6
根据上表数据分析:
①当加入盐酸体积为 mL时,表明NaOH与HCl恰好完全反应.此判断的依据是 .
②当加入6mL盐酸时,烧杯中溶液仍然呈红色,该溶液中含有的溶质有酚酞和 .
③教材指出:酸与碱中和反应的结果是酸和碱各自的特性都消失.图2描述的是氢氧化钠与盐酸反应的微观实质,请从微观的角度分析,甲、乙处应填入的化学符号依次是 、 .
-
(2) 请你参与完成乙组同学的实验记录与分析.
实验操作
实验现象
分析与结论
步骤一:往装有氢氧化钠溶液样品的试管中先滴加2~3滴的 酚酞试液,再逐滴加入稀盐酸
现象一:有气泡产生
现象二:
1.该氢氧化钠溶液样品已变质
2.溶液碱性消失
步骤二:取步骤一反应后的溶液,然后逐滴加入该氢氧化钠溶液样品
现象一:有气泡产生
现象二:溶液开始不变色,后逐渐变成红色
1.产生“气泡”这一现象对应的化学方程式为
2.所取的步骤一反应后的溶液pH 7(填“<”、“=”或“>”)

B . 稀释浓硫酸
B . 稀释浓硫酸
C . 滴加液体
C . 滴加液体
D . 铁丝在氧气中燃烧
D . 铁丝在氧气中燃烧

-
(1) 写出 BC 段相关的化学方程式是。
-
(2) E 点时的溶液中溶质含 (填化学式)
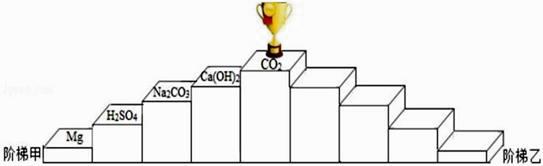
-
(1) 甲阶梯上有 5 种物质,相邻间物质能发生复分解反应的个数是。
-
(2) 为除去 Na2SO4、MgCl2、CaCl2 , 并得到中性的食盐溶液,下列所加试剂和操作:①加过量的 Na2CO3 溶液,②过滤,③加过量的 NaOH 溶液,④加适量的稀 HCl,⑤加过量的 BaCl2 溶液,能达到目的的顺序是
-
(3) 搭建阶梯乙,请你从 O2、Al、Al2O3、HCl、NaOH 中选择 4 种物质放到台阶上,从高到低依次排列,排在倒数第二个台阶上的物质名称是:(从上往下的顺序)。
-
(4) 用 pH 试纸测定溶液酸碱度的操作是。


-
(1) 实验一:向CuSO4溶液中滴入NaOH溶液,观察到的现象为,继续滴加稀盐酸,通过稀盐酸与反应的现象,证明了酸和碱能发生反应。
-
(2) 实验二:向NaOH溶液中滴入几滴酚酞试液,振荡,继续加入稀盐酸,观察到溶液由色变为无色,由此现象也证明了酸和碱能发生反应。实验结束后,小组同学对实验二中试管内的无色溶液成分展开了讨论。
【提出问题】试管中无色溶液的溶质除酚酞外还有什么?
【猜想与假设】猜想一:NaCl和HCl。
猜想二:。
【实验设计】若要证明猜想一成立,下列试剂中不能达到实验目的的是。
A.紫色石蕊试液 B.Zn
C.AgNO3 D.Na2CO3
 B . 闻药品气味
B . 闻药品气味  C . 滴加液体
C . 滴加液体 

-
(1) 为了验证反应③能够发生,你选择的物质是( )A . Na2CO3 B . HCl C . FeCl3 D . Ba(NO3)2
-
(2) 依据反应④,NaOH溶液可以吸收工业尾气中的SO2气体,其化学方程式为: 。

-
(1) “空”杯内涂抹的物质可能是溶液。
-
(2) 此过程中发生反应的化学方程式可能是。
-
(3) 最终溶液为无色,能否说明该溶液一定呈中性?(选填“能”或“不能”),理由。




-
(1) 同时挤压图甲中A、B装置的胶头滴管,能证明氢氧化钠与二氧化碳发生反应的现象是。
-
(2) 为了验证氢氧化钠能与盐反应,可选择的物质是 (可多选)。A . 碳酸钙 B . 氯化铁 C . 硝酸钡 D . 硫酸铜
-
(3) 为鉴别氢氧化钠溶液和氢氧化钙溶液,用如图乙所示的A,B,C三种方案(每种方案的两支试管中事先分别加入等量的上述两种溶液),其中可行的方案是。

 B . 滴加蒸馏水
B . 滴加蒸馏水  C . 振荡土壤液
C . 振荡土壤液 D . 测定酸碱性
D . 测定酸碱性
【查阅资料】下图是某品牌茶垢清洁剂说明书中的部分内容。
|
主要成分:过碳酸钠(化学式为2Na2CO3·3H2O2) 去渍原理:过碳酸钠溶于水时生成碳酸钠(俗称纯碱)和过氧化氢······ |
【提出问题Ⅰ】茶垢清洁剂溶于水时生成过氧化氢,是否生成氧气?
【实验1】在盛有茶垢清洁剂固体的小烧杯中,加适量常温水,完全溶解后得到无色溶液,观察到有小气泡缓慢冒出,伸入带火星的木条,木条不复燃。
【实验2】取三份等量的实验1中的溶液,分别加入甲、乙、丙三支试管中,按下图所示进行实验。观察到都较快产生气泡,且温度越高产生气泡越快;伸入带火星的木条,木条都复燃。

【表达交流Ⅰ】通过实验证明,茶垢清洁剂溶于水时生成氧气。实验1中“木条不复燃”的原因是
【提出问题Ⅱ】茶垢清洁剂溶于水时生成碳酸钠,是否生成氢氧化钠?
【实验3】取实验2丙试管内溶液,按下图所示流程进行实验。

【表达交流Ⅱ】实验中溶液M呈无色,你得出的结论是
【反思总结】
⑴茶垢清洁剂溶于水生成了碳酸钠和过氧化氢。碳酸钠溶液有较好的去污效果,过氧化氢分解生成活性氧,可深层带走污垢。
⑵使用茶垢清洁剂时应选择的水进行溶解,去垢效果更好。



