第四单元 自然界的水 知识点题库
-
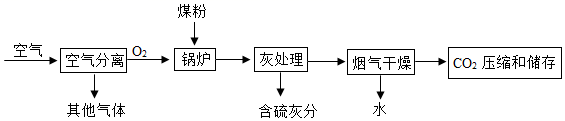
(1) 空气分离的过程中发生的是物理变化,图中其它气体的主要成分是。
-
(2) 该流程中涉及的物质中,属于氧化物的是(写出一种即可)。
(实验一)镁与氧气的反应
(一)制取氧气并探究氯酸钾和二氧化锰制氧气反应物与催化剂的最佳质量比。
实验中采用如图1、2所示装置,取10支试管,在试管中分别加入不同质量的二氧化锰,分别测量二氧化锰与氯酸钾在不同质量比时,生成200mL氧气所消耗的时间。实验数据如表:
|
实验编号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
二氧化锰与氯酸钾的质量比 |
1:20 |
1:10 |
1:6 |
1:5 |
1:4 |
1:3 |
1:2 |
2:3 |
1:1 |
3:2 |
|
生成200mL氧气时间/秒 |
235 |
186 |
162 |
147 |
133 |
117 |
143 |
160 |
211 |
244 |
-
(1) 请回答下列问题:
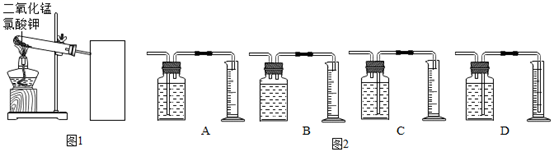
实验开始前先;
-
(2) 为了完成本实验,方框内应选择图2气体收集装置中的(填字母);
-
(3) 分析上述数据,你认为利用此法制氧气,二氧化锰与氯酸钾的最佳质量比为;
-
(4) (二)燃烧镁带
将镁带打磨,点燃,伸入盛满氧气的集气瓶中,产生大量白烟,生成白色固体。
实验结论:镁与氧气反应生成白色的氧化镁。
计算探究:
①氧化镁中氧元素和镁元素的质量比为。
②g氧化镁中所含氧元素的质量与36g水中所含氧元素质量相同。
-
(5) (实验二)镁与氮气的反应
(一)获取氮气:
方法1:工业上把空气液化,然后蒸发,先蒸发出来的气体就是氮气;
方法2:实验室将氨气通过红热的氧化铜,可制得纯净的氮气和铜。
属于化学变化的是(填“方法1”或“方法2”)
-
(6) (二)燃烧镁带
打磨镁带光亮,点燃,伸入盛氮气的集气瓶中,瓶内壁附着一层淡黄色的固体。
实验结论:镁与氮气在点燃的条件下发生化合反应生成淡黄色的氮化镁,其中氮元素的化合价为﹣3,则该反应的符号表达式为
-
(7) (实验三)镁与水蒸气的反应
实验装置如下图所示:

①实验开始时,应先点燃A处酒精灯,等观察到水沸腾后,再点燃B处酒精灯,这样做的目的是;
②生成的气体通入肥皂液中,用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到空中,说明生成的气体是;
实验结论:镁粉能和水蒸气反应,但装置B中并没有产生黑色固体
(探究结论)根据以上信息,可以推理得出镁在空气中燃烧产生的黑色固体是镁与空气中的反应产生的。

| 试剂橱 | A | B | C | D |
| 试剂 | 镁 铜 锌 | 盐酸 硫酸 硝酸 | 高锰酸钾 硫酸铜 氯化钠 | 氧化镁 氧化铜 二氧化锰 |
-
(1) 手机电池基本都是锂离子电池,使用过程中是将化学能转化为能。
-
(2) 电池正极材料含有LiCoO2 , 锂元素(Li)的化合价为+1,则钴元素(Co)的化合价为。
幽门螺旋杆菌检测是体检项目之一、C-l4呼气试验是临床检测幽门螺旋杆菌感染的一种方法。被检测者空腹口服一粒C-l4尿素胶囊,靜坐20min后,用一次性吹气管向二氧化碳吸收剂中吹气,再将吹气完的样品交给医生做检测。
如果胃内有幽门螺旋杆菌,其产生的尿素酶会催化尿素迅速水解成铵根离子和含C-14的碳酸氢根,最终反应生成氨气(NH3)和含C-14的二氧化碳,后者经肺呼出,收集呼气标本并检测其中是否存在放射性元素C-14,便可判断有无幽门螺旋杆菌。
幽门螺旋杄菌的传染力很强,可通过手、不洁食物、不洁餐具等途径传染,其在水中也可以存活,所以日常饮食要养成良好的卫生习惯预防感染。
依据短文内容回答下列问题:
-
(1) C-14是一种放射性原子(质子数6,中子数8),请画出C-14原子结构示意图。
-
(2) 写出文中提到的铵根离子的化学符号。
-
(3) 尿素(CO(NH2)2)和水在尿素酶的催化下反应的化学方程式为。
-
(4) 含C-14的尿素相对分子质量为。
-
(5) 写一条生活中预防幽门螺旋杆菌感染的有效措施。
-
(1) 将水样静置,用如图装置进行过滤,其操作规范的是(填序号)。
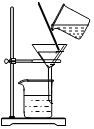
①用玻璃棒引流
②滤纸的边缘低于漏斗口
③液面高于滤纸的边缘
④玻璃棒轻靠在三层滤纸的一边
⑤用玻璃棒在漏斗中轻轻搅动以加快过滤速度
-
(2) 除去难溶性杂质后,可利用活性炭(填“过滤”或“吸附”或“蒸馏”)水样中的异味和色素。
-
(3) 在处理后的水样中加入一定量的,振荡,观察到泡沫较多,说明该水样属于(填“硬水”或“软水”)。
-
(4) 自来水厂的净水过程(填“能”或“不能”)降低水的硬度。生活中将硬水软化的常用方法是;实验室中常用的方法是。
-
(5) 请列举一条日常生活中的节水措施。
 :硫离子结构示意图
D .
:硫离子结构示意图
D .  铁原子中的质子数为26
铁原子中的质子数为26
-
(1) C2H5OH的相对分子质量为;
-
(2) C2H5OH中碳、氧元素的质量比;
-
(3) C2H5OH氢元素的质量分数;
-
(4) 46g酒精中C2H5OH含氢元素的质量为g。
 B . 收集氢气
B . 收集氢气 C . 滴加液体
C . 滴加液体 D . 过滤
D . 过滤
-
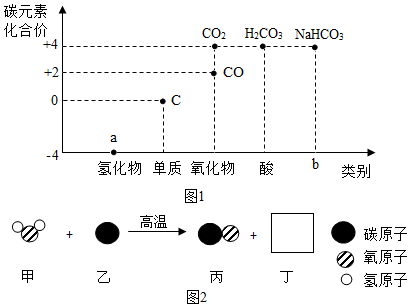
(1) 图1中a物质的化学式为;b处对应的物质类别是,其一种用途是。
-
(2) 价﹣类二维图中的物质在一定条件下可以相互转化。图2是煤炭中的单质碳在一定条件下合成水煤气的微观示意图。该反应为置换反应,则方框丁中微粒的化学式为,参加反应的甲和生成的丙的质量比为。
-
(3) 氧化物中CO有毒而CO2无毒,CO能燃烧而CO2可以灭火,请从微观的角度解释它们化学性质不一样的原因;任写一个CO与CO2相互转化的化学方程式。
 B . 过滤
B . 过滤  C . 检查气密性
C . 检查气密性  D . 稀释浓硫酸
D . 稀释浓硫酸 
-
(1) 用水煎煮时,溶液中Ca(OH)2与K2CO3 , 发生复分解反应,该反应的化学方程式为。
-
(2) 上述过程涉及的实验操作除加热外,还有、(写两个)。
-
(3) KOH与NaOH具有相似的性质,KOH能去除黑痣是因为;《食肉方》中“不宜预作,十日则歇”的原因可能是。



