第一节 化学反应中的质量守恒 知识点题库

-
(1) 点燃酒精灯,在火焰上方罩一个冷而干燥的漏斗,将导气管插入盛有澄清石灰水的烧杯内,观察到漏斗内有水珠出现;澄清石灰水变浑浊.
综合分析,酒精中一定含有元素和元素.
-
(2) 该同学同时发现酒精与蜡烛一样,燃烧时都有明亮的红黄色火焰,他联想到铁在氧气中燃烧、镁条在空气中燃烧却没有火焰.该小组同学进行了如下探究.
①探究Ⅰ:蜡烛燃烧产生火焰的原因是什么?
点燃蜡烛,将玻璃导管一端伸入焰心,导出其中物质,在另一端导管口有“白烟”产生,点燃“白烟”,也有火焰产生(如图2所示).由此可知:蜡烛燃烧产生的火焰是由(填“固态”或“气态”)石蜡燃烧形成的.
②探究Ⅱ:物质燃烧产生火焰的根本原因是什么?
-
(3) 【查阅资料】
物 质
熔点╱℃
沸点╱℃
燃烧时温度╱℃
石蜡
50~70
300~550
约600
铁
1535
2750
约1800
钠
97.8
883
约1400
由上表可知:物质燃烧能否产生火焰与其(填“熔点”或“沸点”)和燃烧时温度有关.由此推测:钠在燃烧时,(填“有”或“没有”)火焰产生.
③木炭在氧气中燃烧没有火焰,但生活中木炭燃烧时会产生火焰,其原因可能是.
物质 | 甲 | 乙 | 丙 | 丁 |
反应前质量/g | 90 | 9 | 0 | 2 |
反应后质量/g | 22 | 45 | 32 | X |
-
(1) 此反应的基本反应类型;
-
(2) X的值,则丁可能是该反应的.
-
(3) 写出一个符合上述反应类型的化学方程式.
物质 | X | Y | Z | W |
反应前质量/g | 4 | 1 | 10 | 2 |
反应后质量/g | 待测 | 5 | 4 | 8 |
下列说法正确的是( )

请回答以下问题:
-
(1) 一个A分子由个原子构成。
-
(2) B中氮、氧元素的质量比为,氮元素的化合价为。
-
(3) 上述反应前后,一定不发生改变的是(填序号)。
①元素种类 ②原子种类 ③分子种类 ④物质种类 ⑤原子个数 ⑥分子个数
-
(4) 参加反应的A与B的分子个数比为。

-
(1) 求反应产生氧气的质量?
-
(2) 求该混合物中氯酸钾的质量?
| 物 质 | 甲 | 乙 | 丙 | 丁 |
| 反应前物质/g | 26 | 2 | 8 | 40 |
| 反应后物质/g | 14 | 22 | 8 | X |
 ,则X的化学式为( )
,则X的化学式为( )
随着人类社会的发展,化石燃料的消耗量急剧增加,释放的CO2越来越多。从而导致温室效应增强,全球气候变暖。科学家一直致力于将CO2分离回收、循环利用和再生转化成资源,化学吸收法是利用吸收剂与CO2发生化学反应来吸收分离CO2的方法,常见的吸收剂有氢氧化钠溶液、氢氧化钙溶液、碳酸钾溶液等,同时加压水洗法也可用于捕获收集CO2。CO2和H2在催化剂的作用下会发生生成甲醇、一氧化碳和甲烷等的一系列反应,实现再生转化。我国科学家在催化剂研究方面取得重大突破,分别合成出了镓酸锌(ZnGa2O4)介孔光催化材料和单晶纳米带,并将其用于CO2的光还原,成功实现了将CO2转化为碳氢化合物燃料。
-
(1) 空气中CO2的主要来源是;
-
(2) 镓酸锌中镓元素的化合价为;
-
(3) 用氢氧化钠溶液吸收二氧化碳的化学方程式为;
-
(4) CO2和H2在催化剂的作用下生成甲醇的原理为
 ,则的化学式为X;
,则的化学式为X;
-
(5) 下列说法正确的是。
A 化石燃料主要包括煤、石油和天然气,属于可再生能源
B 加压水洗法可捕获收集CO2 , 是因为压强增大时CO2在水中的溶解度减小
C 对CO2气体加压降温,可获得干冰,此过程中二氧化碳分子之间的间隔会变小
| 四种物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量/g | 25 | 15 | 1 | 5 |
| 反应后质量/g | 11 | 未测 | 1 | 22 |
 B . 将足量金属铝和铁分别加入到等质量、等浓度的稀盐酸中
B . 将足量金属铝和铁分别加入到等质量、等浓度的稀盐酸中 C . 向HCl和CuSO4的混合溶液中滴加氢氧化钡溶液
C . 向HCl和CuSO4的混合溶液中滴加氢氧化钡溶液 D . 向一定量的稀硫酸溶液中加入水
D . 向一定量的稀硫酸溶液中加入水
-
(1) Ⅰ、研究贝壳的状态对反应速率的影响
取等纯度、等质量的块状和粉末状贝壳,分别加入足量等浓度的稀盐酸,实验过程中生成气体的体积随时间变化的情况如图所示(贝壳中的杂质不与稀盐酸反应)。

结合实验分析图中曲线,可得出结论:。
-
(2) Ⅱ、测定贝壳中碳酸钙的质量分数
小组取10g贝壳,按照如图所示过程进行实验。实验过程中测得不同时刻装置和药品总质量随时间变化的数据见下表。请计算:
时刻
t0
t1
t2
t3
装置和药品总质量/g
240.00
237.00
236.48
236.48
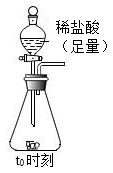
实验中共产生二氧化碳g。
-
(3) 该贝壳中碳酸钙的质量分数(写出计算过程)。
-
(1) 生成SO2的质量为g。
-
(2) 反应后溶液中硫酸铜的质量分数。(温馨提示:
 )。
)。



