单元2 几种常见的酸和碱 知识点题库
实验操作 | 现象 | 结论 | |
A | 向收集满CO2的软塑料瓶中加入约 | 塑料瓶变瘪,溶液变红 | CO2能与石蕊反应 |
B | 往久置于空气中的氢氧化钠溶液滴加稀硫酸 | 有气泡 | 氢氧化钠溶液已变质 |
C | 在某无色溶液中滴加氯化钡溶液 | 有白色沉淀 | 无色溶液中一定含有SO42﹣离子 |
D | 向装有等量水的a、b试管中分别加入NaOH固体、NH4NO3固体 | a试管水温升高,b试管水温降低 | 氢氧化钠固体溶解吸热,硝酸铵溶解放热 |

数型图象是研究化学问题的一种常见描述方法,根据下列图象进行回答:

-
(1) 图一是用盐酸和氢氧化钠进行中和反应时,反应过程中溶液的pH变化曲线.向盐酸中加入的氢氧化钠溶液质量为mg时,所得溶液中含有的离子为(填离子符号);
-
(2) 图二是20℃时,取10mL10%的NaOH溶液于烧杯中,逐滴加入10%的盐酸,随着盐酸的加入,烧杯中溶液温度与加入盐酸体积的变化关系.
①由图可知中和反应是放热反应,你的依据为;
②甲同学用氢氧化钠固体与稀盐酸反应也能得到相同结论,乙同学认为不严密,因为;
-
(3) 图三是a、b、c三种物质的溶解度曲线.a与c的溶解度相交于P点,据图回答:
①t1℃时,接近饱和的c物质溶液,在不改变溶液质量的条件下,可用的方法达到饱和状态;
②将t2℃时,150ga物质的饱和溶液降温到t1℃时,可以析出ga物质.

-
(1) 该实验可证明分子具有的性质是。
-
(2) 请用化学方程式表示红色变为无色的原因。
-
(3) 该实验得出氢氧化钠的性质有。

-
(1) 恰好完全反应时,生成沉淀的质量是g。
-
(2) 请按上述实验中发生反应的先后顺序写出有关反应的化学方程式:;。
-
(3) 该工业盐酸中HCl的质量分数是多少(写出计算过程)?
-
(1) 请以表2中序号Ⅰ为示例,填写序号Ⅱ、Ⅲ中的空格:
项目
序号
举例
物质类别间的相互反应
物质类别间的相互转化
Ⅰ
BaCl2+Na2CO3=BaCO3↓+2NaCl2
盐1﹣盐2
盐→新盐
Ⅱ
写出硫酸与氯化钡反应的化学方程式:
酸﹣盐
酸→
Ⅲ
写出氢氧化钠转变成另一种碱的化学方程式:
碱﹣
碱→新碱
-
(2) 室温下,氯化镁与下列物质的变化关系,正确的是(填标号)。
A.MgCl2﹣AgNO3
B.KNO3→MgCl2
C.MgCl2﹣HCl
D.Mg(OH)2→MgCl2
-
(1) 可用于改良酸性土壤的是;
-
(2) 可用做铅笔芯的是;
-
(3) 可用于除去铁制品表面铁锈的是:。

-
(1) 甲同学将酚酞试液滴入氢氧化钙溶液中,观察到溶液变红,得出结论:氢氧化钙溶液呈(填“酸性”、“碱性”或“中性”);
-
(2) 乙同学将过量的稀盐酸加入到甲同学所得溶液中,观察到的现象是,此时所得溶液中含有的溶质有(酸碱指示剂除外);
-
(3) 丙同学将碳酸钠溶液加入氢氧化钙溶液中,充分反应后,与乙同学所得溶液混合,静置后发现:上层为无色透明的溶液,底部有白色沉淀。则上层溶液中一定含有的溶质是(酸碱指示剂除外);该反应的化学方程式为:;
| 选项 | 实验 | 操作 |
| A | 稀释浓硫酸 | 先将浓硫酸加入烧杯中,后倒入蒸馏水 |
| B | 点燃氢气 | 先检验气体的纯度,后点燃 |
| C | 测定0.4%的氢氧化钠溶液的pH | 先用玻璃棒蘸取溶液,后滴到湿润的pH试纸上 |
| D | 用排水法收集高锰酸钾分解产生的氧气 | 先熄灭酒精灯,后移出导管 |
|
组别 |
第一组 |
第二组 |
|
实验示意图 |
| |
-
(1) 第一组实验中发生反应的化学方程式为,其中酚酞溶液的作用是。
-
(2) 第二组实验中观察到的实验现象是。
-
(3) 实验完毕后,同学们在整理仪器时,将上述实验后的废液倒入同一个洁净的废液缸中,发现混合后的废液显红色,于是引起了他们的探究兴趣。
(提出问题)混合后废液中的溶质有哪些?
(査阅资料)Na2CO3溶液呈碱性。
(做出猜想)猜想I:NaCl、NaOH、Ca(OH)2
猜想II:NaCl、NaOH、Na2CO3
猜想III:NaCl、NaOH。
(实验探究)
小林为了验证混合后废液中的溶质成分,取混合后的废液于试管中,向其中滴加少量的稀盐酸,观察到无明显现象。由此得出结论:猜想II不成立。小华认为小林的结论不严密,因为。小华另取少量混合后的废液于试管中,向其中滴加适量的,观察到有白色沉淀产生,证明猜想II成立。
-
(4) (反思交流)在确定发生反应后所得溶液中的溶质成分时,除了考虑生成物外,还要考虑。

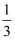 体积滴有石蕊试液的水,旋紧瓶盖,振荡
体积滴有石蕊试液的水,旋紧瓶盖,振荡




