实验7 粗盐的提纯 知识点题库
(一)粗盐提纯

-
(1) 操作①、②、③依次为图中的(填字母) 、 、 .

-
(2) 操作②中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是 (填序号).

-
(3) 若NaCl的产率偏低,则可能的原因是(填字母) .
A.过滤时滤纸有破损 B.蒸发时有固体溅出
C.蒸发后,所得精盐很潮湿 D.溶解含有泥沙的粗食盐时,加入的水量不足.
工业上用海水获取粗盐以及实验室用粗盐制得精盐都包含许多化学实验知识,分析以下过程后填写下列空白:

-
(1) 操作Ⅰ的名称是;
-
(2) 海水晒盐与上述操作中的原理相同;
-
(3)
上述操作可能用到下列装置,装置B中仪器①的名称是,用甲制取淡水可选用装置(填序号),装置A中玻璃棒的作用是.

-
(1) 通过一年的化学学习,我们熟悉了许多物质.请从①石墨;②活性炭;③尿素;
④氢气;⑤食盐;⑥氧气中,选取相应物质的序号填空.
①腌制蔬菜、鱼、肉等常用的调味品是;②最清洁的燃料是;③用于急救病人的气体是;④可作干电池电极的是.
-
(2) 能源与环境成为人们日益关注的问题.2014年世界环境日,中国的主题是“向污染宣战”,倡导全社会共同行动,打一场治理污染的攻坚战.请回答下列有关问题:
①化石燃料燃烧使化学能转化为能,是当今人类生产、生活中重要的能源.但是化石燃料的燃烧会产色和温室气体(填一种),导致温室效应.因此,对于化石燃料的使用,你的看法是:(写一点).
②我国积极发展绿色能源,以减少污染性气体的排放.对于①水力发电;②风力发电;③天然气发电;④太阳能发电;⑤垃圾焚烧发电等5种发电方式,你认为有利于减少温室气体排放的是(填序号).
-
(1) 根据生活经验推测,汗水中产生咸味的物质可能是,该物质是由
(填“原子”、“分子”、“离子”)构成的;
-
(2) 碳酸氢钠是发酵粉的有效成分,碳酸氢钠与稀盐酸反应的化学方程式为;
-
(3) 盛放氢氧化钠的试剂瓶若密封不严会使氢氧化钠发生变质.氢氧化钠变质的原因是(用化学方程式表示);
-
(4) 某无色溶液可能由氢氧化钠溶液、氯化钠溶液、碳酸钠溶液中的一种或几种混合而成.为探究其组成.小华同学进行了如下实验:取适量样品放入试管中,滴加酚酞溶液,溶液变成红色.再向试管中逐滴加入过量氯化钙溶液,观察到有沉淀产生,过滤后滤液仍为红色,由实验现象可推断出样品中一定含有的物质是
(写化学式),可能含有的物质是(写化学式);
-
(5) 向氢氧化钠溶液中不断滴入盐酸,得到如图曲线,a点时溶液中的溶质是.

-
(6) 食用纯碱中常含有少量的氯化钠.现取某食用纯碱样品10g,加入一定量稀盐酸溶液恰好完全反应,同时产生了3.3g气体,试计算该食用纯碱中Na2CO3的质量分数(写出计算过程)
[提出问题]如何才能将粗盐中难溶性杂质和可溶性杂质(氯化镁、氯化钙)除去,从而获得较纯的食盐晶体?
[资料准备]
20℃时,一些物质的溶解度 | OH﹣ | CO32﹣ |
Na+ | 溶 | 溶 |
Ca2+ | 微 | 不 |
Mg2+ | 不 | 微 |
[实验方案]某同学为了提纯粗盐,设计了如下实验方案并进行实验.

[交流与表达]
-
(1) 实验步骤①和②的目的是;实验步骤③和④的目的是.
-
(2) 实验操作X的名称是,该操作中要用到的玻璃仪器有烧杯、玻璃棒和.
-
(3) 实验步骤③的主要目的是(用化学方程式回答);判断氢氧化钠溶液已过量的方法是.
-
(4) 实验步骤④中生成的沉淀D是.(填写名称)
-
(5) 实验步骤⑤用蒸发溶剂的方法而不用降低溶液温度的方法获取食盐晶体,原因是;在蒸发食盐溶液的过程中要使用玻璃棒,作用是.
-
(6) [反思与评价]
有同学认为只需要用氢氧化钠溶液和碳酸钠溶液中任意一种试剂就能将两种可溶性杂质出去,你认为这种方法(选填“可行”或“不可行”),理由是.
-
(7) 有同学认为原实验方案不完善,做出这种评价的依据是.
-
(8) [实验方案设计]
为了完善原实验方案,你设计的实验是.(仅写出补充部分的实验操作和现象)

-
(1) t1℃时,氯化钠的溶解度硝酸钾的溶解度(填“>”、“<”或“=”).
-
(2) 图1中a点的含义是.
-
(3) 若硝酸钾中含有少量氯化钠,要提纯硝酸钾可采用的方法.
-
(4) 某兴趣小组做了如图3提纯NaCl的实验.请根据实验回答下列问题:


①操作Ⅰ、Ⅱ、Ⅲ依次为如图2中的(填字母).
②若得到NaCl的产量比实际值偏低,则可能的原因是(填字母).
A.过滤时滤纸有破损,混合液流入滤液中
B.蒸发时受热不均匀,有晶体溅出
C.蒸发时,看到晶体析出,立即停止加热
D.溶解15g含有泥沙的NaCl样品时,加入水的量不足.

-
(1) 实验中正确的操作步骤是(填序号).
-
(2) ②中使用玻璃棒的目的是.

-
(1) 仪器a的名称是。
-
(2) 有一处操作存明显错误的,请你改正。
-
(3) 正确的操作顺序是(填操作序号),以及称量精盐并计算产率。
-
(4) 使用仪器b在该实验中的优点是,写出乙装置中反应的化学方程为。

-
(1) 上述过程中存在多个复分解反应,其中生成水的有个。
-
(2) 加入Na2CO3溶液的作用是什么?
-
(3) 操作③得到固体的成分有哪些?(写出化学式)
-
(1) 粗盐除含NaCl外,还含有少量MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是粗盐提纯的操作流程。
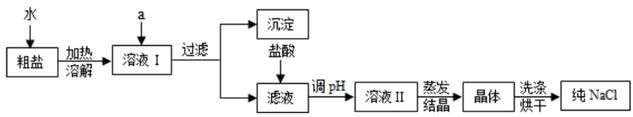
提供的试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、饱和NaCl溶液。
①欲除去溶液Ⅰ中的MgCl2、CaCl2、Na2SO4 , 从提供的试剂中选出a所代表的试 剂,按滴加顺序依次为:过量的NaOH溶液、过量的溶液、过量的溶液
②在滤液中加盐酸的作用是除去;验证盐酸已足量 的方法及现象是。
-
(2) 用提纯的NaCl配制200g0.9%的生理盐水,需要NaCl的质量为。
①配制该溶液时所需要的玻璃仪器有。
②如果配制后溶液溶质的质量分数低于0.9%,你认为可能的原因是。
A称量NaCl的操作不符合题意,如左盘放了纸片而右盘未放
B用量筒量取水时操作有误,如取水时俯视读数
C烧杯中有水
D氯化钠中混有杂质

-
(1) 步骤①的化学方程式为。
-
(2) 步骤②中得到的白色沉淀是(填化学式)。
-
(3) 步骤③中加稀盐酸是为了除去溶液中的。
A CaCl2B MgCl2 C NaOH D Na2CO3

-
(1) 写出Ⅰ中发生反应的化学方程式。
-
(2) 加入过量Na2CO3的作用是。
-
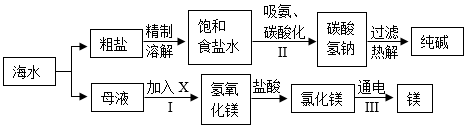
(1) 海水晒盐
①利用盐田法晒盐,盐田通常分为蒸发池和结晶池两部分。下列说法中,不正确的是(填选项序号之一)。
A.在蒸发池中水蒸发所需能量主要为太阳能和风能
B.在结晶池中主要通过降温结晶使氯化钠析出
C.当氯化钠晶体析出时,结晶池中的溶液为氯化钠的饱和溶液
②粗盐中常含有泥沙等难溶性杂质。在实验室中除去粗盐中的难溶性杂质,可依次通过溶解、过滤、蒸发结晶等操作,每步操作都会用到的一种玻璃仪器是(填仪器名称)。
-
(2) 海水制镁
①为了使海水中含量较低的镁元素富集,工业生产中在第Ⅰ步反应中应加入适量的,(写化学式),则该反应属于反应。(填写“化合”“分解”“复分解”“置换”之一)
②请写出第Ⅲ步,电解熔融状态的 MgCl2制取 Mg 的化学方程式。
-
(3) 海水“制碱”
①1926 年我国著名化学家侯德榜先生创立了侯氏制碱法,促进了世界制碱技术的发展。侯氏制碱法以食盐为主要原料制取纯碱。在流程Ⅱ中,先向饱和精盐水中通入氨气再通入二氧化碳。从酸碱反应的角度分析,氨盐水比食盐水更容易吸收二氧化碳的原因是。
②工业上制得的纯碱中常含有少量氯化钠。Na2CO3和 NaCl 的溶解度曲线如图所示,试回答下列问题:

a.将 t2℃时碳酸钠饱和溶液的温度降到 t1℃,溶液中碳酸钠的质量分数会(填“变大”“变小” “不变”之一)。
b.t1℃时,将不同质量的碳酸钠饱和溶液和氯化钠饱和溶液均升温到 t2℃,此时所得碳酸钠溶液溶质质量分数氯化钠溶液溶质质量分数(填“大于”“等于”或“小于”或“无法判断”之一)。
c.t2℃时,在 90g 水中加入 45gNa2CO3 , 经充分溶解,所得溶液中溶质与溶剂的质量之比为(填最简整数比)。
-
(1) 用化学方程式表示用盐酸除铁锈的反应原理:。
-
(2) 某小组将氢氧化钠溶液逐滴滴加到稀硫酸中,并通过温度传感器测得溶液温度变化曲线如下图所示。

由图可知该反应是放热反应,当滴入氢氧化钠溶液12g时,溶液中的溶质为。若改用溶质质量分数相同的氢氧化钾溶液,滴入10g时溶液pH(填“>”“<”或“=”)7。
-
(3) 从海水得到的粗盐中往往含有泥沙和氯化钙、氯化镁、硫酸钠等杂质,某化学兴趣小组进行了如下操作:

①操作③中玻璃棒的作用是。
②加入过量Na2CO3溶液的作用是。
③按照上图所示流程,能否用价格更便宜的熟石灰代替氢氧化钠来提纯氯化钠?请说明理由 。
④滤液B中含有哪些杂质?请设计实验加以证明。(简要写出实验步骤、现象和结论)
-
(4) 某航天器上有3名航天员,如果每人每天呼出0.88kgCO2 , 假如呼出的CO2全部被LiOH吸收,则该航天器工作10天需要LiOH的质量是?



