第一单元 走进化学工业 知识点题库
请将序号填在相应的横线上:
(1)浓硫酸敞口放置在空气中,其质量增加,浓度降低 ;
(2)浓硫酸使湿润石蕊试纸变红,后来又变黑 ;
(3)常温下,浓硫酸能使铁、铝钝化 ;
(4)实验室用乙醇和冰醋酸制取乙酸乙酯
Ⅰ.方法一:
-
(1) 浓硫酸试剂瓶上适合贴上的标签是(填序号).

-
(2) 甲同学取6.4 g铜片和10 mL 18 mol•L﹣1浓硫酸,放在试管中共热时发现,铜与热的浓硫酸反应后并没有得到预期的蓝色溶液,而是在试管底部看到灰白色沉淀.甲同学为了验证其中白色沉淀主要成分.设计下列实验:
实验步骤:倾倒掉上层液体后,向所得灰白色的固体中加入适量蒸馏水,边加边搅拌.
实验现象:;
实验结论:所得白色固体的化学式为.
-
(3) 乙还观察到加热过程中,起初液面以上出现大量白色烟雾,在试管内壁上部析出少量淡黄色固体物质,持续加热,淡黄色固体物质又慢慢地溶于浓硫酸而消失.淡黄色固体消失的原因是(用化学反应方程式回答).直到最后反应完毕,发现试管中还有铜片剩余.乙根据自己所学的化学知识,认为试管中还有硫酸剩余.他这样认为的理由是.
-
(4) Ⅱ.方法二:
丙同学认为甲设计的实验方案不好,他自己设计的思路是:2Cu+O2
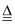 2CuO,CuO+H2SO4═CuSO4+H2O.对比甲的方案,你认为丙同学的优点是①,②.
2CuO,CuO+H2SO4═CuSO4+H2O.对比甲的方案,你认为丙同学的优点是①,②. -
(5) 方法三:
丁同学取一铜片和稀硫酸放在试管中,再向其中滴入双氧水,发现溶液逐渐呈蓝色.写出反应的化学反应方程式.

-
(1) 实验室可用Na2O2与H2SO4反应制取少量的H2O2 , Na2O2的电子式为.
-
(2) 一种正在开发的利用O2和H2O作原料通过化合制取H2O2的方法,其原理如1图所示.该方法制取H2O2
的总化学反应方程式为
-
(3) 医疗上可用质量分数为3%过氧化氢溶液对伤口进行消毒,其消毒原理是.
-
(4) 为探究外界条件对H2O2分解化学反应速率的影响,相关实验设计如表所示:
试管编号
实验目的
H2O2溶液
温度
水的体积/mL
FeCl3溶液体积/mL
质量分数
体积/mL
Ⅰ
为编号Ⅱ实验参照
12%
5.0
常温
0
0
Ⅱ
温度对反应速率的影响
5.0
60℃
0
0
Ⅲ
为编号Ⅳ实验参照
4.0%
5.0
常温
0
Ⅳ
4.0%
5.0
常温
0
1.0
填写表中缺少的内容:Ⅱ;Ⅲ;Ⅳ.
-
(5) 由铂(Pt)和金(Au)组成的纳米棒放入H2O2溶液中(如下图),纳米棒将发生定向移动.
则:Au一侧为电池的极(选填:“正”或“负”);纳米棒向(选填:“左”或“右”)移动.
-
(6) 断裂1mol过氧化氢中的O﹣O键和氧气中的O=O键所需的能量依次分别为142kJ•mol﹣1、497.3kJ•mol﹣1 . 则反应2H2O2(l)═2H2O(l)+O2(g)△H=kJ•mol﹣1 .


①它们位于三个不同短周期,核电荷数依次增大 ②B与F同主族.
③B、C分别都能与D按原子个数比1:1或1:2形成化合物.
④A、E分别都能与D按原子个数比1:1或2:1形成化合物.
⑤E元素的电离能数据如下 (kJ•mol-1):
|
I1 |
I2 |
I3 |
I4 |
… |
|
496 |
4562 |
6912 |
9540 |
… |
-
(1) 写出只含有A,B,D,E四种元素的一种无水盐的化学式。
-
(2) B2A2分子中存在个σ键,个π键。
-
(3) BD2分子中B原子的杂化方式是。
-
(4) 人们通常把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可以用于计算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.下表列出了上述部分元素形成的化学键的键能:
化学键
F-D
F-F
D=D
键能/kJ•mol-1
460
176
497.3
试计算1mol F单质晶体燃烧时的反应热△H=。(已知1molF单质中含2mol F-F键,1mol FO2中含有4mol F-O键)
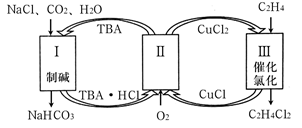
 氧化
氧化 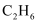 制
制  对资源综合利用有重要意义。相关的主要化学反应有:
对资源综合利用有重要意义。相关的主要化学反应有: Ⅰ 

Ⅱ 

Ⅲ 

Ⅳ 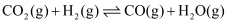

已知:  时,相关物质的相对能量(如图1)。
时,相关物质的相对能量(如图1)。

可根据相关物质的相对能量计算反应或变化的 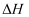 (
( 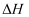 随温度变化可忽略)。例如:
随温度变化可忽略)。例如: 
 。
。
请回答:
-
(1) ①根据相关物质的相对能量计算

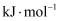 。
。 ②下列描述正确的是
A 升高温度反应Ⅰ的平衡常数增大
B 加压有利于反应Ⅰ、Ⅱ的平衡正向移动
C 反应Ⅲ有助于乙烷脱氢,有利于乙烯生成
D 恒温恒压下通水蒸气,反应Ⅳ的平衡逆向移动
③有研究表明,在催化剂存在下,反应Ⅱ分两步进行,过程如下:


 ,且第二步速率较慢(反应活化能为
,且第二步速率较慢(反应活化能为  )。根据相关物质的相对能量,画出反应Ⅱ分两步进行的“能量-反应过程图”,起点从
)。根据相关物质的相对能量,画出反应Ⅱ分两步进行的“能量-反应过程图”,起点从  的能量
的能量  ,开始(如图2)
,开始(如图2)。

-
(2) ①
 和
和 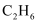 按物质的量1:1投料,在
按物质的量1:1投料,在  和保持总压恒定的条件下,研究催化剂X对“
和保持总压恒定的条件下,研究催化剂X对“  氧化
氧化 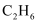 制
制  ”的影响,所得实验数据如下表:
”的影响,所得实验数据如下表: 催化剂
转化率

转化率

产率

催化剂X
19.0
37.6
3.3
结合具体反应分析,在催化剂X作用下,
 氧化
氧化 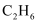 的主要产物是,判断依据是。
的主要产物是,判断依据是。②采用选择性膜技术(可选择性地让某气体通过而离开体系)可提高
 的选择性(生成
的选择性(生成  的物质的量与消耗
的物质的量与消耗 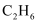 的物质的量之比)。在
的物质的量之比)。在  ,乙烷平衡转化率为
,乙烷平衡转化率为  ,保持温度和其他实验条件不变,采用选择性膜技术,乙烷转化率可提高到
,保持温度和其他实验条件不变,采用选择性膜技术,乙烷转化率可提高到  。结合具体反应说明乙烷转化率增大的原因是。
。结合具体反应说明乙烷转化率增大的原因是。
-
(1) Ⅰ.①图1是由
 制取C的太阳能工艺。已知过程1中
制取C的太阳能工艺。已知过程1中 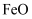 与
与  反应时
反应时  ,则
,则  的化学式为。
的化学式为。
②过程1生成
 的反应热为
的反应热为  ;过程2产生
;过程2产生  的反应热为
的反应热为  。则制取C的反应
。则制取C的反应  的
的  为。
为。
-
(2) Ⅱ.以
 和
和  为原料合成尿素的化学方程式为
为原料合成尿素的化学方程式为  。
。
合成的粗尿素中含有
 杂质。通过控制温度和压强,可将
杂质。通过控制温度和压强,可将  分解为
分解为  和
和  。研究温度和压强对
。研究温度和压强对  分解率的影响,结果如下:
分解率的影响,结果如下:
若X代表压强,则温度:

 (填“>”或“<”)。
(填“>”或“<”)。 -
(3) 工业上含尿素的废水需经处理后才能排放。如图为一种电化学降解尿素的装置示意图,该过程中,尿素降解的产物之一为
 :
:

写出尿素被降解的电极反应式:。
-
(4) Ⅲ.在200℃时,向
 带气压计的恒容密闭容器中通入
带气压计的恒容密闭容器中通入  和
和  发生反应
发生反应  ,测得初始压强为
,测得初始压强为  ,反应过程中容器内总压强(P)随时间(t)变化(反应达到平衡时的温度与起始温度相同)如图所示。
,反应过程中容器内总压强(P)随时间(t)变化(反应达到平衡时的温度与起始温度相同)如图所示。

该反应过程中从
 到
到 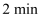 压强变小原因是。
压强变小原因是。 -
(5)
 内,反应的平均反应速率
内,反应的平均反应速率  。
。
-
(6) 用平衡分压代替平衡浓度表示的化学平衡常数
 。[气体分压
。[气体分压  气体总压
气体总压  气体体积分数]
气体体积分数]

已知:乌托洛品(  )在强酸溶液中易水解。
)在强酸溶液中易水解。
-
(1) ClCH2COOH 和 NH3 生成甘氨酸和氯化铵的化学方程式为 。
-
(2) 为了保证乌洛托品的催化效果,应控制反应体系 pH8~9。
①乌洛托品水解得到甲醛和氨的物质的量之比为。
②应控制反应 ii 原料 n(ClCH2COOH):n(NH3)为 1:1 的原因为。
-
(3) 为提高甘氨酸产率,应控制适宜反应温度。下列说法正确的是____(填标号)。A . 升高温度,反应 i 的速率一定加快 B . 为减少反应 ii 升温造成 NH3 逸出,可将 NH3 替换为 NH4HCO3 C . 高温加剧乌洛托品水解,生成的甲醛自聚使溶液粘度增大,影响甘氨酸的结晶 D . 高温加剧甘氨酸自聚,使反应液颜色变深,影响甘氨酸品体颜色
-
(4) ClCH2COOH 在碱性条件下受热水解,生成副产物羟基乙酸,其化学方程式为。为避免该副反应的发生,可将溶剂水替换成醇。
-
(5) “电渗析法”分离甘氨酸和氯化铵的装置示意图为:

①A 膜为离子交换膜(填“阳”或“阴”)。
②阳极生成 O2 的电极反应式为 。
③甘氨酸在水溶液中的存在形式与溶液的 pH 关系如下:

淡化室溶液的 pH 应控制为 5.97(填“>”或“=”或“<”)。
 2SO3(g)的能量变化如图所示,下列说法错误的是( )
2SO3(g)的能量变化如图所示,下列说法错误的是( ) 
 与足量澄清石灰水反应得到100g沉淀,则表示乙醇燃烧的热化学方程式是( )
与足量澄清石灰水反应得到100g沉淀,则表示乙醇燃烧的热化学方程式是( )

 B .
B . 
 C .
C . 
 D .
D . 

-
(1) CO2-CH4催化重整可得到合成气:CH4(g)+CO2(g)
 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。 已知:C(s)+2H2(g)
 CH4(g) ΔH=-75 kJ·mol-1
CH4(g) ΔH=-75 kJ·mol-1C(s)+O2(g)
 CO2(g) ΔH=-394 kJ·mol-1
CO2(g) ΔH=-394 kJ·mol-1C(s)+
 O2(g)
O2(g)  CO(g) ΔH=-111 kJ·mol-1
CO(g) ΔH=-111 kJ·mol-1①该催化重整反应的ΔH=kJ·mol-1。
②某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为。
③反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。
积碳反应:CH4(g)
 C(s)+2H2(g);消碳反应:CO2(g)+C(s)
C(s)+2H2(g);消碳反应:CO2(g)+C(s)  2CO(g)。
2CO(g)。在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为。

-
(2) 利用电化学装置可实现CH4和CO2两种分子的耦合转化,其原理如图所示。

①阴极上的反应式为。
②若生成的乙烯和乙烷的体积比为2:1,则消耗的CH4和CO2体积比为。
-
(3) CO2与甲醇直接合成DMC(CH3OCOOCH3)近年来备受关注。一种在有氧空位的催化剂上合成DMC的反应机理如图所示。

①上述过程包括吸附和脱附,其中属于脱附的是(填数字)。
②合成DMC的反应方程式为。
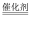 C2H4Cl2+2CuCl
C2H4Cl2+2CuCl

 利用技术,降低空气中
利用技术,降低空气中  含量成为研究热点。
含量成为研究热点。
-
(1) I.研究证明,
 可作为合成低碳烯烃的原料,目前利用
可作为合成低碳烯烃的原料,目前利用  合成乙烯相关的热化学方程式如下:
合成乙烯相关的热化学方程式如下: 反应ⅰ:

反应ⅱ:

反应ⅲ:

反应ⅳ:

反应ⅰ为反应(填“放热”或“吸热”),能正确表示该反应的图示是(填标号)。

-
(2) 计算可知∆H4=,则利用反应ⅳ生产标准状况下
 时,放出热量。
时,放出热量。
-
(3) II.具有广泛应用前景的新型
 电化学储能系统吸引了广大科研工作者的研究兴趣。
电化学储能系统吸引了广大科研工作者的研究兴趣。  电池中,
电池中, 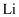 为单质锂片,该电池反应产物为碳酸锂和单质碳。
为单质锂片,该电池反应产物为碳酸锂和单质碳。 则该电池中的
 在(填“正”或“负”)极发生电化学反应。
在(填“正”或“负”)极发生电化学反应。 -
(4)
 电池工作的总反应式为。
电池工作的总反应式为。
-
(5) III.可利用电还原方法将
 转化成燃料。
转化成燃料。  在碱性介质中电还原为甲醇(
在碱性介质中电还原为甲醇(  )的电极反应式为。
)的电极反应式为。
|
化学键 |
C-H | C-C | C=C | H-H |
|
键能 |
413 |
347 |
614 |
436 |
则下列有关反应 的说法正确的是( )
的说法正确的是( )

 D . 该反应为放热反应,无需加热即可发生该反应
D . 该反应为放热反应,无需加热即可发生该反应




