第四节 研究有机化合物的一般步骤和方法 知识点题库
-
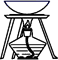
(1) 选取必要的实验装置,正确的连接顺序为(填序号).
-
(2) 为确定制得的固体样品是纯净的NaHCO3 , 小组同学提出下列实验方案:
甲方案:将样品溶液与饱和澄清石灰水反应,观察现象.
乙方案:将样品溶液与BaCl2溶液反应,观察现象.
丙方案:测定pH法.
丁方案:热重分析法.
①判定甲方案(填“可行”或“不可行”).
②为判定乙方案的可行性,某同学用纯净的NaHCO3配制的溶液,与BaCl2溶液等体积混合进行实验,结果如下:
NaHCO3溶液
BaCl2浓度
0.2mol•L﹣1
0.1mol•L﹣1
0.02mol•L﹣1
0.2mol•L﹣1
浑浊
浑浊
少许浑浊
0.1mol•L﹣1
浑浊
少许浑浊
无现象
0.02mol•L﹣1
少许浑浊
无现象
无现象
(i)此实验已可说明乙方案是不可行的.请结合以下数据,并通过计算说明产生浑浊的原因.
[已知:0.1mol•L﹣1 NaHCO3溶液电离出的c(CO32﹣)为0.0011mol•L﹣1 , Ksp(BaCO3)=5.1×10﹣9]
答:.
(ii)产生浑浊(伴有气体产生)的离子方程式.
③用pH计测定的丙方案如下:
取m克的固体样晶溶解于水配成V mL的溶液,用pH计测pH:
还应补充的实验是:
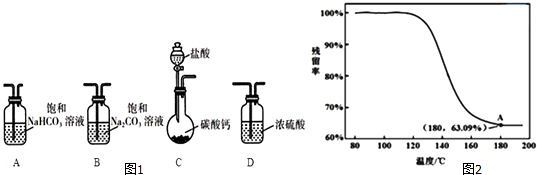
④进行丁方案实验,得到固体残留率随温度变化的曲线如图2所示,根据A点坐标得到的结沦是.
(残留率=
 ×100%)
×100%)
 和
和 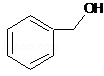 分子组成相差一个﹣CH2﹣,因此是同系物关系
B .
分子组成相差一个﹣CH2﹣,因此是同系物关系
B . 甲同学认为:两者反应生成只有CuCO3一种沉淀;
乙同学认为:这两者相互促进水解反应,生成Cu(OH)2一种沉淀;
丙同学认为:生成CuCO3和Cu(OH)2两种沉淀.
[查阅资料知:CuCO3和Cu(OH)2均不带结晶水]
-
(1) Ⅰ.按照乙同学的理解反应的化学反应方程式为:;
在探究沉淀物成分前,须将沉淀从溶液中分离并净化.具体操作为①过滤②洗涤③干燥.
-
(2) Ⅱ.请用如图1所示装置,选择必要的试剂,定性探究生成物的成分.
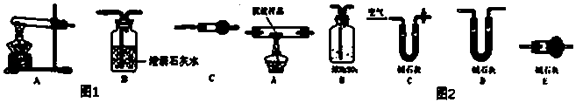
(1 )各装置连接顺序为→→.
(2 )装置C中装有试剂的名称是.
(3 )能证明生成物中有CuCO3的实验现象是.
-
(3) Ⅲ.若CuCO3和Cu(OH)2两者都有,可通过如图2所示装置的连接,进行定量分析来测定其组成.
(1 )装置C中碱石灰的作用是,实验开始时和实验结束时都要通入过量的空气其作用分别是,.
(2 )若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为:.(用m、n表示)
【提出假设】
假设1:沉淀为CuCO3;
假设2:沉淀为…………;
假设3:沉淀为碱式碳酸铜[化学式可表示为nCu(OH)2•mCuCO3].
【查阅资料】这三种沉淀受热均易分解,都生成黑色固体CuO.
【实验探究】
步骤1:将所得悬浊液过滤,先用蒸馏水洗涤,再用无水乙醇洗涤,风干;
步骤2:取一定量所得固体,用如图装置(夹持仪器未画)进行定性实验;
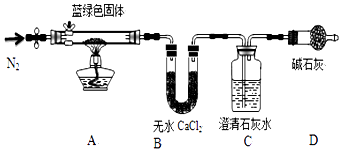
-
(1) 【问题讨论】
假设2中的沉淀为,提出该假设的理论依据是
-
(2) 步骤1用无水乙醇洗涤,再风干的目的
-
(3) 装置D装有碱石灰的干燥管所起的作用是
-
(4) 若反应后A中蓝绿色固体变黑,C中澄清石灰水变浑浊,证明假设(填写序号)一定不成立
-
(5) 乙同学认为只要将图中B装置的试剂改用下列某试剂后,通过观察便可验证上述所有假设,该试剂是(填代号)
a.浓硫酸 b.无水CuSO4 c.碱石灰 d.P2O5
-
(6) 该小组经试验确定假设3成立,他们想进一步测定蓝绿色固体的化学式,丙同学查得一些物质在20℃的数据(如下表)后,建议将C中的澄清石灰水改为Ba(OH)2溶液,其原因是(双选,填代号)
溶解度(s)/g
溶度积(Ksp)
摩尔质量(M)g/mol
Ca(OH)2
Ba(OH)2
CaCO3
BaCO3
CaCO3
BaCO3
0.16
3.89
2.9×10﹣9
2.6×10﹣9
100
197
a.Ba(OH)2溶解度大于Ca(OH)2 , 能充分吸收CO2
b.Ba(OH)2为强碱,Ca(OH)2为弱碱
c.吸收等量CO2生成的BaCO3的质量大于CaCO3 , 测量误差小
d.相同条件下,CaCO3的溶解度明显大于BaCO3
-
(7) 作上述调整后,若所取蓝绿色固体质量为27.1g,实验结束后装置B中无水氯化钙的质量增加2.7g,C中氢氧化钡溶液里产生沉淀的质量为19.7g.则该蓝绿色固体的化学式为.
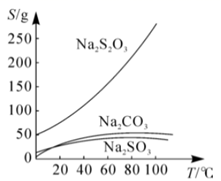
已知:
①
| 10 | 20 | 30 | 40 | 50 | 70 |
(NH4)2SO4 | 73.3 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
FeSO4•7H2O | 40.0 | 48.0 | 60.0 | 73.3 | ﹣ | ﹣ |
(NH4)2SO4•FeSO4•6H2O | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
②莫尔盐在乙醇溶剂中难溶.
Ⅰ.莫尔盐的制取

试分析:
-
(1) 步骤2中加热方式 (填“直接加热”“水浴加热”或“沙浴”);必须在铁屑少量剩余时,进行热过滤,其原因是.
-
(2) 步骤3中包含的实验操作名称.
-
(3) 产品莫尔盐最后用洗涤(填字母编号).
a.蒸馏水 b.乙醇 c.滤液
-
(4) Ⅱ.为测定硫酸亚铁铵(NH4)2SO4FeSO46H2O晶体纯度,某学生取m g硫酸亚铁铵样品配制成500mL溶液,根据物质组成,甲、乙、丙三位同学设计了如下三个实验方案,请回答:
(甲)方案一:取20.00mL硫酸亚铁铵溶液用0.1000molL﹣1的酸性KMnO4溶液分三次进行滴定.
(乙)方案二:取20.00mL硫酸亚铁铵溶液进行如下实验.
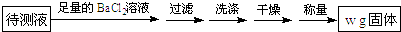
若实验操作都正确,但方案一的测定结果总是小于方案二,其可能原因为,验证推测的方法为:.
(丙)方案三:(通过NH 4+测定)实验设计图如下所示.取20.00mL硫酸亚铁铵溶液进行该实验.
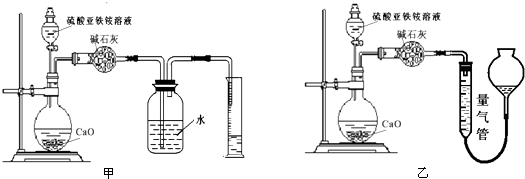
-
(5) ①装置(填“甲”或“乙”)较为合理,判断理由是.量气管中最佳试剂是 (填字母编号.如选“乙”则填此空,如选“甲”此空可不填).
a.水b.饱和NaHCO3溶液c.CCl4
②若测得NH3的体积为V L(已折算为标准状况下),则该硫酸亚铁铵晶体的纯度为.
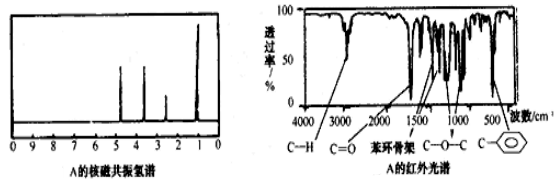
方法一:用质谱法分析得知A的相对分子质量为136。
方法二:核磁共振仪测出A的核磁共振氢谱有4个峰,其面积之比为1∶2∶2∶3。如下图。
方法三:利用红外光谱仪测得A分子的红外光谱,如下图。
-
(1) 分子中共有种化学环境不同的氢原子。
-
(2) A的分子式为。
-
(3) 该物质属于哪一类有机物。
-
(4) A的分子中只含一个甲基的依据是(填序号)。
a.A的相对分子质量
b.A的分子式
c.A的核磁共振氢谱图
d.A分子的红外光谱图
-
(5) A的结构简式为。
-
(6) A的芳香类同分异构体有多种,其中又同时符合下列条件:①属于酯类;②分子结构中含有一个甲基。则该芳香类A的同分异构体共有种。
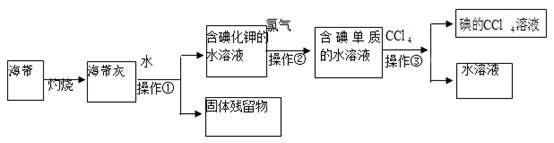
请回答下列问题:
-
(1) 操作①的名称为、;
-
(2) 向含碘单质的水溶液中加入CCl4振荡、静置后,观察到的现象是;
-
(3) 操作③中,将含碘单质的水溶液与CCl4在分液漏斗中混合、振荡摇匀放在铁架台的铁圈上,分液漏斗的下端尖嘴处紧贴在承接的烧杯内壁上静置后,下面的操作步骤是。
-
(4) 从含碘的有机溶剂中经过蒸馏可以提取碘和回收有机溶剂,该实验需要的主要玻璃仪器除酒精灯、烧杯、温度计、锥形瓶、牛角管外,还需要,实验中温度计水银球所处位置为。
| 选项 | A | B | C | D |
| 实验 | 用CCl4提取溴水中的Br2 | 除去乙醇中的苯酚 | 从KI和I2的固体混合物中回收I2 | 配制100 mL 0.100 0 mol·L−1 K2Cr2O7溶液 |
| 装置或仪器 | | | | |
-
(1) Ⅰ.制备Na2S2O3·5H2O:
将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在仪器b中加入亚硫酸钠固体。在仪器a中注入硫酸,并按如图安装好装置。
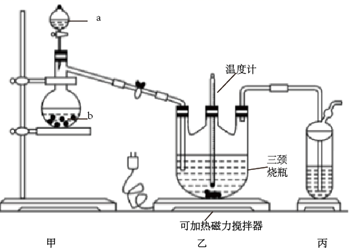
仪器a的名称为,装置丙的作用是。
-
(2) 打开a的活塞,注入硫酸使反应产生的二氧化硫气体较均匀的通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热,装置乙中的反应过程为:
①Na2CO3+SO2=Na2SO3+CO2
②Na2S+SO2+H2O=Na2SO3+H2S
③2H2S+SO2=3S↓+2H2O
④
写出④的反应方程式__。
随着SO2气体的通入,看到溶液中有大量浅黄色固体析出,继续通SO2气体,反应约半小时。当溶液中pH接近或不小于7时,即可停止通气和加热。溶液pH要控制不小于7的理由是:(用文字和相关离子方程式表示)。
-
(3) Ⅱ.分离Na2S2O3·5H2O并测定含量:

为提高产率,操作①为,操作②是过滤洗涤干燥,其中洗涤操作是用(填试剂)作洗涤剂。
-
(4) 蒸发浓缩滤液直至溶液呈微黄色浑浊为止,蒸发时为什么要控制温度不宜过高。
-
(5) 为了测定粗产品中Na2S2O3·5H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(滴定反应为假定粗产品中杂质与酸性KMnO4溶液不反应)。称取1.28g的粗样品溶于水,用0.40mol·L-1酸性KMnO4溶液滴定,当溶液中S2O
 全部被氧化时,消耗酸性KMnO4溶液20.00mL。那么,产品中。
全部被氧化时,消耗酸性KMnO4溶液20.00mL。那么,产品中。
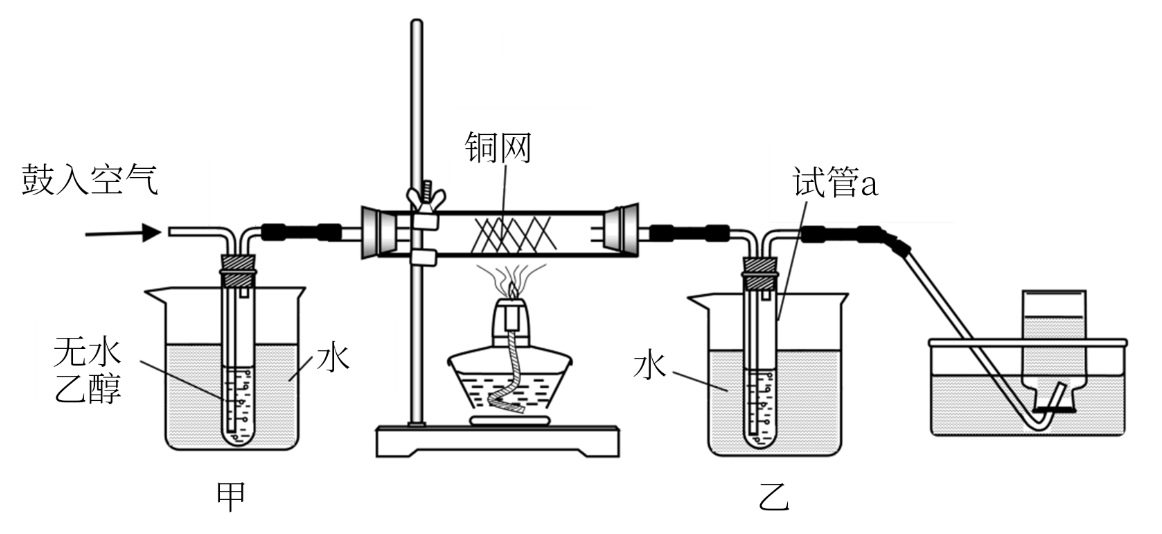
-
(1) 实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式。
-
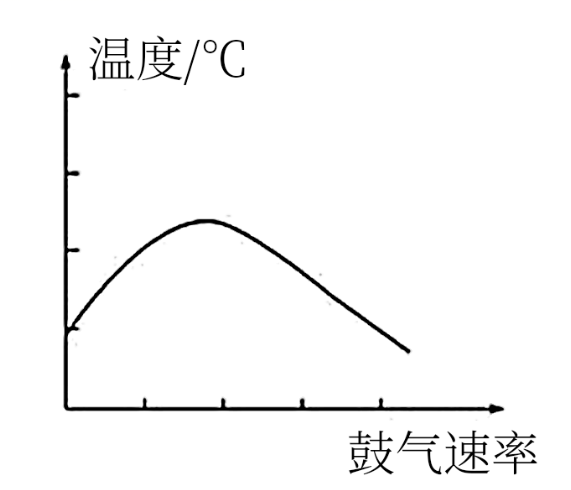
(2) 在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化氧化反应是(填“放热”或“吸热”)反应。进一步研究表明,鼓入空气的速率与反应体系的温度关系曲线如下图所示。试解释出现图中现象的原因。
-
(3) 甲和乙两个水浴作用不相同。甲的作用是;乙的作用是。
-
(4) 若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有。要除去该物质,可在混合液中加入(填写字母)。
A.氯化钠溶液B.苯
C.碳酸氢钠溶液D.四氯化碳
然后,再通过(填实验操作名称)即可除去。