第三单元 海水淡化 知识点题库
海藻中含有丰富的、以离子形式存在的碘元素.下图是实验室从海藻里提取碘的流程的一部分。
下列判断正确的是( )
-
(1)
目前,国际上使用的“海水淡化”技术主要有蒸馏法、膜分离方法、电渗析法等.
(1)蒸馏法所需玻璃仪器有酒精灯、锥形瓶、尾接管和 、 .
(2)电渗析法原理如图1所示:
①淡水从 口(填“a”或“b”)流出;为了防止海水中的SO42﹣、Ca2+、Mg2+堵塞交换膜,需加入药品对之净化除去,则药品加入顺序次依是NaOH、 、


②电渗析法制取淡水的过程中产生的电解产物,用来处理二氧化硫的废气并回收二氧化硫及氯化钠,其循环的流程如图2.请写出反应、有关的化学反应方程式:
-
(2) 海水中蕴含着丰富的化学资源如镁、钾、铀.
(3)从海水中提取镁的部分步骤如下:
m.将蒸发结晶得到的MgCl2•6H2O在一定条件下加热,得到无水MgCl2;
n.电解熔融的氯化镁制金属镁.
步骤m中的“一定条件”指的是 ,目的是 ;步骤n不用熔融氧化镁制金属镁的原因是
(4)铀是核反应最重要的燃料之一,已经研制成功一种螯合型离子交换树脂,它专门吸附海水中的U4+ , 而不吸附其他元素.其反应原理为 (树脂用HR代替),发生离子交换后的离子交换膜用酸处理还可再生并得到含铀的溶液,其反应原理为
①将海带灰转移到小烧杯中,向其中加入10mL蒸馏水,搅拌、煮沸2﹣3min;
②取3g左右的干海带,剪碎后用酒精润湿,放入坩埚中,灼烧海带至完全变成灰烬,停止加热,冷却;
③向溶液中加入四氯化碳,振荡、静置、分液,得到含碘的有机溶液;
④向含碘离子的溶液中滴入几滴稀硫酸,再加入1mL 3%H2O2溶液;
⑤过滤,得到含碘离子的溶液;
请回答下列问题:
-
(1) 实验步骤的合理顺序是(填序号).
-
(2) 步骤③中使用的主要仪器是.
-
(3) 步骤④中反应的离子方程式是.



A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50mL碘水和15mL CCl4 加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层水溶液;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽(或小孔)对准漏斗口上的小孔;
H.静置,分层.
就此实验,完成下列填空:
-
(1) 正确操作步骤的顺序是:(用上述各操作的编号字母填写)
→→→A→G→→E→F.
-
(2) 上述E步骤的操作中应注意.上述G步骤操作的目的是.
-
(3) 能选用CCl4从碘水中萃取碘的原因是.
-
(4) 已知碘在酒精中的溶解度比在水中大得多,能不能用酒精来萃取碘水中的碘(填“能”或“不能”),其理由是.

-
(1) 海藻灼烧时是将带其放入(填仪器名称)中,用酒精灯充分加热灰化.
-
(2) 指出提取碘的过程中有关的实验操作名称:①②、.
-
(3) 用CCl4从碘水中提取碘经过操作②后,有机溶剂在(填“上”或“下”)层,有机层呈色.
-
(4) 从含碘的有机溶液中提取碘和回收有机溶剂还需经过蒸馏,指出图2实验装置中的错误之处并改正:
①
②.

下列说法错误的是( )
-
(1) 向海水中通入氯气将海水中的溴化物氧化,其离子方程式为:。
-
(2) 向上述混合液中吹入热空气,将生成的溴吹出,用纯碱溶液吸收,这时,溴就转化成溴离子和溴酸根离子,其化学方程式为:;通入空气吹出Br2,并用Na2CO3吸收的目的是。
-
(3) 将(2)所得溶液用H2SO4酸化,又可得到单质溴,再用有机溶液萃取溴后,还可以得到副产品Na2SO4。 这一过程可用化学方程式表示为:。
-
(4) 为了除去工业Br2中微量的Cl2,可向工业Br2中加入(填字母)。
a.CCl4 b.NaBr溶液 c.NaOH溶液 d.Na2SO3溶液
-
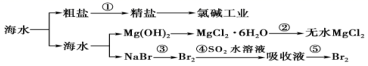
(1) I.工业上对海水资源综合开发利用的部分工艺流程如下图所示:

请回答下列问题:
物质C和M均为强氧化性物质,则C的电子式为,M的学化式为。
-
(2) 反应⑤的化学方程式是。
-
(3) 工业制镁采用电解熔融氯化镁,不采用电解熔融氧化镁的原因是。
-
(4) 将氯化镁晶体(MgCl2·6H2O)加热到523℃以上,该晶体可以分解得到耐火材料氧化镁和两种气态化合物,其中一种气体常温下为无色液体,请写出MgCl2·6H2O在523℃时发生以上分解的化学方程式是。
-
(5) II.其课外小组在实验室完成了下列有关实验,设计以下装置(夹持装置己略去),进行实验,模拟海水提溴的部分过程。
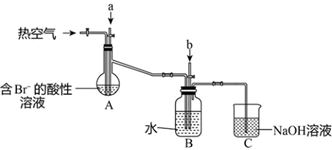
a是一种黄绿色气体。A装置中通入a气体的目的是(用离子方程式表示)。
-
(6) 反应过程中,B装置中有
 生成,则气体b的化学式是。检验B装置的溶液中含有
生成,则气体b的化学式是。检验B装置的溶液中含有  的方法是。
的方法是。
-
(7) C装置的作用是。

回答下列问题:
-
(1) 从海水中获得淡水的主要方法有电渗析法、离子交换法和。
-
(2) 为了使海水中的Mg2+沉淀下来,充分利用当地的贝壳资源获得试剂A,试剂A的化学式是,这样做的优点是。
-
(3) 操作I是;操作II是在一定条件下蒸发浓缩,,过滤,洗涤,干燥;操作III涉及的化学方程式是。
-
(4) 吸收塔中会生成NaBr、NaBrO3 , 同时产生一种气体,化学方程式是。
-
(5) 酸化浓缩时已产生Br2 , 工业生产中还需经过吹出、吸收、酸化等过程,目的是。
-
(6) 已知海水中Br-含量为65mg•L-1 , 若主业上制得含65% Br2的产品1t,至少需要海水m3。

-
(1) 为了使
 转化为
转化为 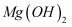 ,试剂①可以选用,要使
,试剂①可以选用,要使  完全转化为沉淀,加入试剂①的量应;
完全转化为沉淀,加入试剂①的量应;
-
(2) 加入试剂①后,能够分离得到
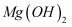 沉淀的方法是;
沉淀的方法是;
-
(3) 试剂②可以选用;
-
(4) 无水
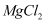 在熔融状态下,通电后会产生
在熔融状态下,通电后会产生  和
和  ,该反应的化学方程式为:
,该反应的化学方程式为: 。
 是新型絮凝剂,可用来处理水中的悬浮物
是新型絮凝剂,可用来处理水中的悬浮物
-
(1) 利用1:氯碱工业
从海水中提取粗盐的方法是。
-
(2) 图1是氯碱工业中电解饱和氯化钠溶液的示意图,饱和氯化钠溶液从a口进入,NaOH溶液从(填b或d)口导出。阳离子交换膜的作用是。
-
(3) 图2是电解氯化钠溶液的微观示意图。X为电源的极,水合钠离子、水合氯离子吸引水分子的氢原子朝向不同的原因。

-
(4) 利用2:提镁工业
从海水中提取镁的流程图如下,按示例所示补全缺少的流程:。

 吸收
吸收 蒸气:
蒸气: B . 将煤气化为可燃性气体:
B . 将煤气化为可燃性气体: C . 用电解法冶炼金属镁:
C . 用电解法冶炼金属镁: 熔融
熔融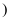
 D . 燃煤时加入
D . 燃煤时加入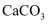 脱硫:
脱硫:
![]()
下列说法错误的是( )



