课题2 用纸层析法分离铁离子和铜离子 知识点题库

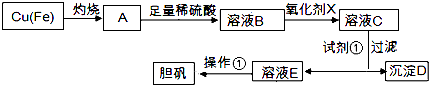
已知:
溶液中被沉淀的离子 | Fe3+ | Fe2+ | Cu2+ |
完全生成氢氧化物的沉淀时,溶液的pH | ≥3.7 | ≥6.4 | ≥4.4 |
请回答:
-
(1) 下列物质中最适宜做氧化剂X的是 (填字母).A . NaClO B . H2O2 C . KMnO4
-
(2) 加入试剂①是为了调节pH,试剂①可以选择(填化学式).
-
(3) 操作①的名称是.
-
(4) 沉淀D加入盐酸可以得到FeCl3溶液,关于FeCl3溶液的性质中说法不正确的是 .A . 将FeCl3饱和溶液逐滴加入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔效应 B . 向FeCl3溶液滴加NaOH溶液,出现红褐色沉淀 C . 将FeCl3溶液滴加NaOH溶液,将沉淀干燥灼烧,得到Fe(OH)3固体 D . 向FeCl3溶液中滴加KSCN溶液,溶液变为红色
-
(5) 沉淀D加入盐酸和铁粉,可以制得FeCl2溶液,实验室保存FeCl2溶液,需加入过量的铁粉防止FeCl2溶液变质,其原因是(用离子方程式表示).

下列说法正确的是( )
现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去溶液中的NaCl和Na2SO4 , 从而得到纯净的NaNO3溶液.相应的实验过程可用如图表示:

请回答下列问题:
-
(1) 写出实验流程中下列物质的化学式:试剂X,沉淀B.
-
(2) 证明AgNO3加过量的实验方法是.
-
(3) 按此实验方案得到的溶液3中肯定含有(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的,之后若要获得固体NaNO3需进行的实验操作是(填操作名称).

请回答下列问题:
-
(1) 试剂X的电子式,沉淀A的晶体类型,CO32﹣的空间构型是.
-
(2) 上述实验流程中加入过量的Na2CO3的目的是.发生反应的离子方程式是:.
-
(3) 按此实验方案得到的溶液3中肯定含有(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的,之后若要获得固体NaNO3需进行的实验操作是(填操作名称).

-
(1) “加压浸出”生成TeO2的离子方程式为,“加压浸出”时控制pH为4.5~5.0,酸性不能过强的原因是。
-
(2) “盐酸酸浸”后将SO2通入浸出液即可得到单质碲,该反应中氧化剂与还原剂物质的量之比为,该流程中可循环利用的物质是(填化学式)。
-
(3) 已知:Ksp(Ag2SO4)=7.70×10-5 , Ksp(AgCl)=1.80×10-10。盐酸酸浸时,“浸出渣1”中Ag2SO4可充分转化为AgCl。通过计算说明为什么可以实现充分转化。
-
(4) NaOH碱浸时反应的离子方程式为。流程中,电解过程用石墨为电极得到碲,阴极的电极反应式为。
-
(5) 浸出法是工业提取金属常用的方法,某实验小组用1.0mol· L-1的草酸在75℃时浸出镍。随时间变化,不同固液比对镍浸出率的影响曲线如图所示。


①由图可知,固液比与镍浸出率的关系是。
②除固液比之外,你认为影响金属浸出率的因素还有(至少两项)。
-
(1) 下列关于实验的叙述中正确的有______________(填字母)。A . 酒精灯使用结束后,应立即吹灭 B . 不慎将酸沾到皮肤或衣物上,应立即用浓NaOH溶液清洗 C . 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 D . 取用Na2SO4溶液时,发现取量过多,为了不浪费,应把多余的试剂倒入原试剂瓶中 E . 称量氢氧化钠固体时,应先在天平两个托盘上各放一张相同质量的纸,再把氢氧化钠固体放在纸上称 F . 使用分液漏斗前要检查其是否漏水 G . 测量溶液pH值时,应先将pH试纸润湿
-
(2) 化学家研究物质的组成和性质时,首先需要将被研究的物质从混合物中分离出来并加以提纯,以下是常见的可用于分离或提纯物质的部分仪器和方法:
仪器:

方法:① 过滤;② 结晶;③ 蒸馏;④ 萃取分液。
请将相应的字母填入空白处:
实验
所需仪器
方法
除去水中混有的泥沙
从海水中获取淡水
分离碘和水的混合物
从海水中获取粗盐
-
(3) 实验室用63%的浓HNO3(其密度为1.4 g·mL-1)配制480 mL 0.25 mol·L-1稀HNO3;可供选用的仪器有:a.胶头滴管 b.烧瓶 c.烧杯 d.药匙 e.托盘天平 f.10 mL量筒 g.50 mL量筒
回答下列问题:
Ⅰ.此浓硝酸的物质的量浓度为mol·L-1。
Ⅱ.量取63%的浓硝酸时应选用(填仪器的字母编号)量取mL。
Ⅲ.实验时,上述仪器中还需要选用的有(填字母),还缺少的仪器有、(写仪器名称)。
Ⅳ.配制过程中,下列操作会使配制的稀硝酸溶液浓度偏低的是(填序号)。
①用量筒量取浓硝酸时,眼睛俯视刻度线
②容量瓶使用时底部残留有水
③定容时眼睛俯视刻度线
④移液时不小心有少量液体洒到瓶外
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线


下列说法正确的是( )
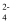 + 2HBr
C . ③中主要发生的是置换反应
D . 用酒精萃取精溴中的单质溴
+ 2HBr
C . ③中主要发生的是置换反应
D . 用酒精萃取精溴中的单质溴
 ,在0~5℃、强碱性溶液中较稳定。某兴趣小组利用如图所示装置(夹持、加热等装置略)制取
,在0~5℃、强碱性溶液中较稳定。某兴趣小组利用如图所示装置(夹持、加热等装置略)制取  并探究其性质。回答下列问题:
并探究其性质。回答下列问题:
-
(1) Ⅰ.制取


仪器a的名称是,装置D的作用是(用离子方程式表示)。
-
(2) 装置A中反应的离子方程式为。
-
(3) 装置C中反应为放热反应,控制反应温度在0-5℃的方法是。
-
(4) Ⅱ.探究
 性质。取装置C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有
性质。取装置C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有  。
。  生成的可能原因:①
生成的可能原因:①  氧化
氧化  ;②(用离子方程式表示)。为探究
;②(用离子方程式表示)。为探究  产生的原因,设计以下方案:
产生的原因,设计以下方案:方案甲
取少量溶液a,滴加KSCN溶液至过量,溶液量红色
方案乙
用KOH浓溶液充分洗涤C中所得晶体,再用KOH稀溶液将
 溶解,得紫色溶液b。取少量溶液b,滴加盐酸,有
溶解,得紫色溶液b。取少量溶液b,滴加盐酸,有  产生
产生由方案甲中溶液变红知溶液a中含有(填离子符号),但该离子不一定是
 将
将  氧化所得,还可能由产生(用离子方程式表示)。方案乙可证明酸性条件下
氧化所得,还可能由产生(用离子方程式表示)。方案乙可证明酸性条件下  氧化
氧化  产生
产生  。
。
 已知:生成氢氧化物沉淀的pH如表所示:
已知:生成氢氧化物沉淀的pH如表所示:
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
注:金属离子的起始浓度为0.1mol/L,回答下列问题:
-
(1) 含杂质的菱锰矿使用前需将其粉碎,主要目的是,盐酸溶解MnCO3的化学方程式是。
-
(2) 向溶液1中加入双氧水时,反应的离子方程式是。
-
(3) 滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+ , 反应的离子方程式是。
-
(4) 将MnCl2转化为MnO2的另一种方法是电解法。
①阳极生成MnO2的电极反应式是。
②若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2 , 检验Cl2的操作是。
③若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生。其原因是。
 水解所得乙醇分子中有
水解所得乙醇分子中有  D . 粗苯甲酸经过加热溶解、趁热过滤、蒸发结晶,可获得纯苯甲酸
D . 粗苯甲酸经过加热溶解、趁热过滤、蒸发结晶,可获得纯苯甲酸
![]() 已知:①I2(s)+I-(aq)
已知:①I2(s)+I-(aq)  I
I  (aq)。
(aq)。
②水合肼(N2H4·H2O)具有强还原性,可将各种价态的碘还原为I- , 氧化产物为N2。
③NaI易被氧化,易溶于水、酒精,在酒精中的溶解度随温度的升高增加不大。
回答下列问题:
-
(1) ①步骤Ⅰ,I2与Na2CO3溶液同时发生两个反应,生成物除NaI外,还分别生成NaIO和NaIO3 , 一个反应为:I2+Na2CO3=NaI+NaIO+CO2↑,另一个反应为:。
②I2与Na2CO3溶液的反应很慢,加入NaI固体能使开始反应时的速率明显加快,原因可能是。
-
(2) 步骤Ⅱ,水合肼与IO
 反应的离子方程式为。
反应的离子方程式为。
-
(3) 步骤Ⅲ,多步操作为:
①将步骤Ⅱ得到的pH为6.5~7的溶液调整pH至9~10,在100℃下保温8h,得到溶液A;
②将溶液A的pH调整至3~4,在70~80℃下保温4h,得溶液B;
③将溶液B的pH调整至6.5~7,得溶液C;
④在溶液C中加入活性炭,混合均匀后煮沸,静置10~24h后,过滤除杂得粗NaI溶液。
上述①②③操作中,调整pH时依次加入的试剂为、、。
A.NaOH B.HI C.NH3•H2O D.高纯水
-
(4) 步骤Ⅳ,蒸发操作为减压蒸发。
①“减压蒸发”需选用的仪器除了圆底烧瓶、蒸馏头、温度计、接收管、接收瓶之外,还有。
A.直形冷凝管
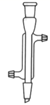 B.球形冷凝管
B.球形冷凝管 
C.烧杯
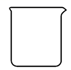 D.抽气泵
D.抽气泵 
②采用“减压蒸发”的优点有:减小压强,降低沸点,利于水的蒸发;。
-
(5) 将制备的NaI•2H2O粗品以无水乙醇为溶剂进行重结晶。请选择合理的操作并排序:加热乙醇→→→→→纯品(选填序号)。
①高纯水洗涤 ②减压蒸发结晶 ③真空干燥 ④NaI•2H2O粗品溶解 ⑤趁热过滤 ⑥降温结晶


已知:①NH4VO3是白色粉末,微溶于冷水,可溶于热水。
②NH4VO3  V2O5+2NH3↑+H2O
V2O5+2NH3↑+H2O
③V2O5是一种橙黄色片状晶体,微溶于水,不溶于乙醇,具有强氧化性。
④部分稀土金属氯化物在乙醇中溶解度较小。
-
(1) “碱浸”时对赤泥进行粉碎的目的是。写出滤液1中通入足量CO2时所发生主要反应的离子方程式:。
-
(2) 将磁性产品加入稀硝酸溶解,取上层清液再加入KSCN溶液后未见红色,写出该磁性产品与稀硝酸反应的离子方程式:。
-
(3) “洗涤”操作时可选用的洗涤剂有___。(填字母)A . 冷水 B . 热水 C . 1%NH4Cl溶液 D . 乙醇
-
(4) 需在流动空气中灼烧的原因可能是。
-
(5) 将0.253g产品溶于强碱溶液中,加热煮沸,调节pH为8~8.5,向反应后的溶液中加入硫酸酸化的KI溶液(过量),溶液中的还原产物为V3+离子,滴加指示剂,用0.250mol•L-1Na2S2O3溶液滴定,达到终点时消耗Na2S2O3标准溶液20.00mL,则该产品的纯度为。
(已知:I2+2Na2S2O3=Na2S4O6+2NaI,结果保留三位有效数字)
-
(6) 水系锌离子电池是一种新型二次电池,以Zn(CF3SO3)2(三氟甲磺酸锌)为电解质,工作原理如图。放电时V2O5电极上的电极反应式为。

 、NO。工业上变“废”为宝,吸收工业尾气
、NO。工业上变“废”为宝,吸收工业尾气  和NO,获得
和NO,获得 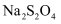 和
和  产品的流程如图(Ce为铈元素),下列说法错误的是( )
产品的流程如图(Ce为铈元素),下列说法错误的是( ) 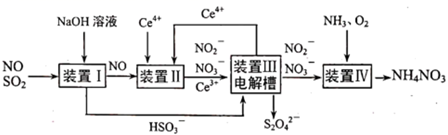
 的VSEPR模型是平面三角形
B . “装置Ⅲ”进行电解,
的VSEPR模型是平面三角形
B . “装置Ⅲ”进行电解,  在阴极反应,使
在阴极反应,使 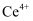 得到再生
C . “装置Ⅳ”进行氧化,1L
得到再生
C . “装置Ⅳ”进行氧化,1L 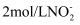 的溶液,至少需要标准状况下
的溶液,至少需要标准状况下 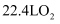 D . “装置Ⅳ”获得粗产品
D . “装置Ⅳ”获得粗产品  的实验操作为蒸发浓缩、冷却结晶
的实验操作为蒸发浓缩、冷却结晶
![]()
以下推断不合理的是( )



