专题五 电化学问题研究 知识点题库

如图表示电解饱和NaCl溶液的装置,X、Y是石墨棒.实验开始时,在两边同时各滴入几滴酚酞溶液,请回答以下问题:

①X极上的电极反应式是,在X极附近观察到的现象是;
②Y电极上的电极反应式是,检验该电极反应产物的方法是.
③电解NaCl溶液的离子方程式是.



 2O3
B . 高压放电出来的空气中,除含臭氧外还含有氮的氧化物
C . 电解纯水时,电极b周围发生的电极反应有6OH--6e-=O3↑+3H2O和4OH--4e-=O2↑+2H2O
D . 电解水时,H+由电极a经聚合电解质薄膜流向电极b
2O3
B . 高压放电出来的空气中,除含臭氧外还含有氮的氧化物
C . 电解纯水时,电极b周围发生的电极反应有6OH--6e-=O3↑+3H2O和4OH--4e-=O2↑+2H2O
D . 电解水时,H+由电极a经聚合电解质薄膜流向电极b

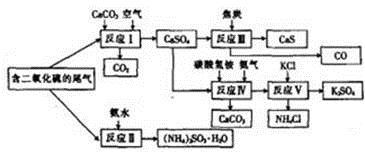
-
(1) 写出反应Ⅲ的化学方程式:。
-
(2) 下列有关说法正确的是_________(填字母)A . 反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙 B . 反应Ⅱ和反应Ⅲ的基本反应类型相同 C . 反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解 D . 反应Ⅴ中的副产物氯化铵可用作氮肥
-
(3) (NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式:。
-
(4) 很多硫酸厂为回收利用SO2 , 直接用氨水吸收法处理尾气。
①用15.0 mL 2.0 mol/L氨水吸收标准状况下448 mL SO2 , 吸收液中的溶质为。
②某同学用酸性KMnO4溶液滴定上述吸收液,当达到滴定终点时,消耗KMnO4溶液25.00mL,则酸性KMnO4溶液中c(KMnO4) =。
-
(5) 氨气用途广泛,可以直接用于燃料电池,下图是用氨水作原料的燃料电池的工作原理。
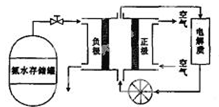
氨气燃料电池的电解质溶液最好选择(填“酸性”、“碱性”或“中性”)溶液,氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池总反应的化学方程式是,负极的电极反应式是。


-
(1) 若C为稀H2SO4 , 电流表指针发生偏转,B电极材料为Fe且作负极,则A电极上发生的电极反应式为;反应进行一段时间后溶液C的pH将(填“升高”“降低”或“基本不变”)。
-
(2) 若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则A(负极)极材料为,B(正极)极材料为;溶液C为。
-
(3) 若C为CuCl2溶液,Zn是极,Cu极发生反应,电极反应式为反应过程溶液中c(Cu2+)(填“变大”“变小”或“不变”)。

 复合电极,b的电极反应式为
复合电极,b的电极反应式为  。下列说法正确的是( )
。下列说法正确的是( ) 
 B . 内电路中,
B . 内电路中,  由b极区向a极区迁移
C . 工作一段时间后,两极NaCl溶液的浓度差减小
D . 电路中转移
由b极区向a极区迁移
C . 工作一段时间后,两极NaCl溶液的浓度差减小
D . 电路中转移  时,理论上a极区模拟海水的质量减少23g
时,理论上a极区模拟海水的质量减少23g
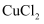 溶液的电解反应。分别用石墨电极电解
溶液的电解反应。分别用石墨电极电解  溶液和
溶液和  溶液,记录实验现象如下表。
溶液,记录实验现象如下表。 | 实验装置 | 实验编号及试剂 | 实验现象 |
| | ① | 阳极:产生有刺激性气味的气体 阴极:电极上有红色固体析出 |
| ② | 阳极:产生有刺激性气味的气体 阴极:电极上有少量红色固体和白色固体析出,同时电极附近液体变为黑色 |
-
(1) 经检验,阳极产生的气体能使湿润的淀粉KI试纸变蓝。①中电解反应的化学方程式为。
-
(2) Ⅰ.探究②中产生白色固体的原因。
查阅资料:
i.阴极附近的白色固体为
 ;
;ii.
 在水溶液中单独存在时不稳定,容易发生反应:
在水溶液中单独存在时不稳定,容易发生反应:  。
。结合资料分析CuCl产生的路径有如下两种可能:
路径1:阴极发生电极反应分两步:
i.
ⅱ.
 ,同时伴随反应
,同时伴随反应  ,生成白色沉淀。
,生成白色沉淀。 -
(3) 路径2:阴极发生电极反应
 ,而后发生反应a:(写出离子方程式),生成白色沉淀。同学们通过实验证明反应a可以发生,其实验操作和现象是。
,而后发生反应a:(写出离子方程式),生成白色沉淀。同学们通过实验证明反应a可以发生,其实验操作和现象是。
-
(4) Ⅱ.探究②中阴极区液体中黑色物质的成分。
进一步查阅资料,提出以下猜想。
猜想1.生成氢氧化铜,进而转化为极细小的氧化铜;
猜想2.生成铜的速率快,形成黑色纳米铜;
猜想3.发生反应
 (棕黑色)。
(棕黑色)。若猜想1成立,则阴极一定还存在的电极反应是。
取2mL黑色液体于试管中,分别加入不同试剂,记录实验现象如下表。
实验编号
③
④
⑤
加入试剂
4mL浓

4mL浓HCl

实验现象
溶液变澄清,呈绿色,试管口有浅红棕色气体生成
黑色液体颜色变深
溶液变澄清,呈绿色,同时出现少量白色沉淀
-
(5) 甲同学根据实验③产生的现象得出结论:黑色液体中一定有纳米铜。乙同学认为甲同学的结论不合理,他做出判断的依据是。
-
(6) 由上述实验可得到的关于黑色物质成分的结论是。
-
(1) 以
 和
和  为原料合成尿素是利用
为原料合成尿素是利用  的成功范例。在尿素合成塔中的主要反应:
的成功范例。在尿素合成塔中的主要反应:
反应Ⅰ:

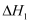
反应Ⅱ:


总反应Ⅲ:


①反应Ⅰ的
 kJ/mol。
kJ/mol。②一定温度下,恒容的密闭容器中按化学计量数比投料进行反应Ⅲ,下列能说明反应Ⅲ达到化学平
衡状态的是。
A.容器内气体总压强不再变化 B.
 与
与  的浓度相等
的浓度相等C.
 D.
D.  保持不变
保持不变 -
(2) 利用工业废气中的
 可以制取甲醇,
可以制取甲醇,  ,一定条件下往1L的密闭容器中充入
,一定条件下往1L的密闭容器中充入 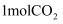 和
和 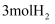 ,在不同催化剂作用下发生反应Ⅰ、反应Ⅱ与反应Ⅲ,相同时间内
,在不同催化剂作用下发生反应Ⅰ、反应Ⅱ与反应Ⅲ,相同时间内  的转化率随温度变化如(图一)所示:
的转化率随温度变化如(图一)所示:

①b点v(正)v(逆)(填“>”、“<”、“=”)
②温度为
 时,该反应的平衡常数K=。
时,该反应的平衡常数K=。③若某温度下反应已达平衡,下列措施中有利于提高
 平衡转化率的是。
平衡转化率的是。A.使用高效催化剂 B.不断分离出产物
C.提高原料气中
 的比例 D.升温
的比例 D.升温 -
(3) 电解法转化
 可实现
可实现  资源化利用,电解
资源化利用,电解  制CH4的原理如(图二)所示。铜电极上发生的电极反应式是。
制CH4的原理如(图二)所示。铜电极上发生的电极反应式是。
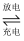 LNixCoyMnxO2 +6C(石墨),其电池工作原理如图4所示,两板之间有一个允许特定离子X通过的隔膜。下列说法错误的是( )
LNixCoyMnxO2 +6C(石墨),其电池工作原理如图4所示,两板之间有一个允许特定离子X通过的隔膜。下列说法错误的是( ) 

-
(1) a极为(填“正”或“负”)极,c 极为(填“阴”或“阳”)极。
-
(2) 乙装置中电解饱和NaCl溶液的化学方程式为;反应一段时间后,d极产生1mol气体时,乙装置中转移电子mol。
-
(3) 下列说法正确的是____(填字母序号)。A . 甲装置可实现化学能向电能的转化 B . 甲装置中Na+透过阳离子交换膜向a极移动 C . 乙装置中c极一侧流出的是浓盐水
-
(4) 实际生产中,阳离子交换膜的损伤会造成OH- 迁移至阳极区,从而在电解池阳极能检测到O2 , 产生O2的电极反应式为。

 D . 当溶液中有4mol
D . 当溶液中有4mol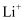 向多孔碳电极移动时,有32g空气被还原
向多孔碳电极移动时,有32g空气被还原

-
(1) H2O分子用电子式表示为。该反应中每生成0.5 mol甲醇,转移电子的物质的量是mol。
-
(2) 一定条件下,该反应过程中的能量变化情况如图所示,图中E2-E1 =kJ·mol−1。

-
(3) T1℃下,向一容积为3 L的恒容密闭容器中加入一定量的CO2和H2 , 在催化剂存在时发生反应:CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g),测得不同时间(t)各物质的物质的量如下表:
CH3OH(g) + H2O(g),测得不同时间(t)各物质的物质的量如下表:t / min
n(CO2) / mol
n(H2) / mol
n(CH3OH) / mol
n(H2O) / mol
0
2.00
6.00
0
0
t1
1.65
a
0.35
0.35
t2
b
3.60
0.80
0.80
t3
b
3.60
0.80
0.80
①0 ~ t1 min内,用H2浓度变化表示该反应的化学反应速率为mol·L−1·min−1。
②下列有关上述反应的说法正确的是(填序号)
A.CH3OH中的化学键是共价键
B.消耗3 mol H2(g)的同时生成1 mol H2O(g),此时该反应达到化学平衡
C.0 ~ t1 min内反应放出的热小于t1~ t2 min内放出的热
-
(4) 甲醇(CH3OH)燃料电池的电极采用膜电极,该电极由催化剂层和质子交换膜构成,其中质子交换膜能传导H+ , 同时作为隔膜防止两极的物质相互反应。该电池的工作原理如图:

①该电池的负极是。(填“电极a”或“电极b”)
②工作时,电极b的电极反应式是。




