第2节 铝 金属材料 知识点题库
请回答下列问题:
-
(1) 下图所示装置用于制备绿矾。其中锥形瓶中盛放的药品或原料是,集气瓶的作用是;烧杯中主要发生:①CuSO4+H2S=CuS↓+H2SO4 , ②4CuSO4+PH3+4H2O=H3PO4+4H2SO4+4Cu,则烧杯中盛放的试剂是,其作用是。

-
(2) 下图所示装置用于制备硫酸亚铁铵。在0~60 ℃的温度范围内,硫酸亚铁铵在水中的溶解度比硫酸铵、硫酸亚铁的溶解度小,冷却混合液至室温便析出硫酸亚铁铵。具体操作:①打开活塞,关闭活塞,从分液漏斗滴入6 mol·L-1H2SO4到250 mL锥形瓶,充分反应。②待锥形瓶中的铁屑快反应完时,关闭活塞,打开活塞。③放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵。

-
(3) 在制备硫酸亚铁的过程中,理论上控制铁过量或酸过量均有利于防止Fe2+被氧化。设计两个实验:实验一,控制酸过量;实验二,控制铁过量;其余步骤相同,制得硫酸亚铁铵,并对产品质量进行检测。检测结果如下:
序号
反应物用量
产品质量
1
n(H2SO4)∶n(Fe)>1∶1
介于Ⅰ级~Ⅱ级之间
2
n(H2SO4)∶n(Fe)<1∶1
优于Ⅰ级
已知产品质量标准:Fe3+的质量分数等于0.005%,产品质量定为Ⅰ级;Fe3+的质量分数等于0.01%,产品质量定为Ⅱ级,从实验结果中,可得出制备硫酸亚铁溶液时,反应控制过量为最佳。
A,B,C,D,E五种物质均含有同一元素,且A为单质,有如图所示的转化关系.则下列判断不正确的是( )

①制铝合金 ②制电线 ③制炊具 ④银色漆颜料 ⑤明矾净水 ⑥明矾与苏打制食品膨松剂 ⑦易拉罐 ⑧用Al(OH)3凝胶制胃舒平药片 ⑨包装糖果和小食品.
 B .
B .  C .
C .  D .
D . 
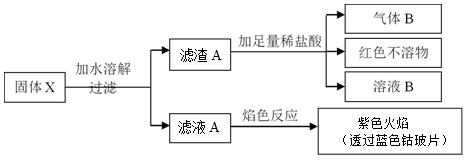
下列有关说法正确的是( )
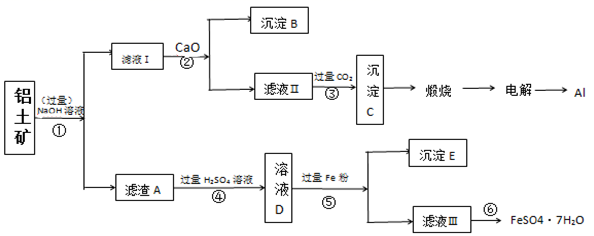
-
(1) 步骤①中提高碱浸速率的方法。
-
(2) 滤液Ⅰ中主要的阴离子是,沉淀B的化学式,步骤③的离子方程式:。
-
(3) 步骤⑤加入过量的铁粉的目的(用离子方程式解释)
-
(4) 检验滤液Ⅲ中的金属阳离子的方法是:。
-
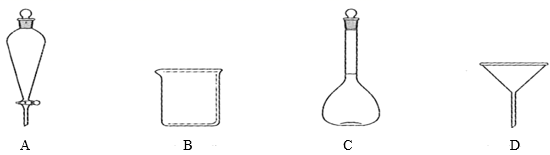
(5) 滤液Ⅲ经过,,过滤得到硫酸亚铁晶体,过滤时需要的玻璃仪器有(填标号)。
-
(6) 利用上述工艺流程测定铝土矿中铁元素的质量分数,取10g样品,最终得到5.56g的FeSO4·7H2O晶体,该铝土矿中铁元素的质量分数。
 、
、  、
、  、
、  、
、  、
、  、
、  ,现取三份
,现取三份  溶液进行如下实验:
溶液进行如下实验: ①第一份加入 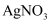 溶液有沉淀产生
溶液有沉淀产生
②第二份加足量  溶液加热后,收集到气体
溶液加热后,收集到气体 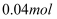
③第三份加足量  溶液后,得干燥沉淀
溶液后,得干燥沉淀 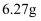 ,经足量盐酸洗涤、干燥后,沉淀质量为
,经足量盐酸洗涤、干燥后,沉淀质量为  .根据上述实验,以下推测正确的是( )
.根据上述实验,以下推测正确的是( )
 一定存在
B .
一定存在
B . 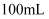 溶液中含
溶液中含  C . Cl-一定存在
D .
C . Cl-一定存在
D .  一定不存在,
一定不存在,  可能存在
可能存在

回答下列问题:
-
(1) 实验一:FeC2O4·2H2O晶体的制备
打开K1、K3和K4 , 关闭K2 , 向装置A中加入稍过量的稀硫酸。
①A中溶液由无色逐渐变为浅绿色,该反应的离子方程式为。
②同时A中有气体产生,该气体的作用是。
-
(2) 收集H2并验纯后,打开K2 , 关闭,让A中浅绿色溶液流入B中,以生成FeC2O4 , 分离得FeC2O4·2H2O晶体。
-
(3) 实验二:K3[Fe(C2O4)3]的制备
将实验一得到的FeC2O4·2H2O溶于水,加入H2O2、H2C2O4和K2C2O4 , 酒精灯微热并不断搅拌,反应制得K3[Fe(C2O4)3]。
①写出该反应的化学方程式。
②“微热、搅拌”的目的是;若加热温度太高,对反应造成的主要影响是。
③从上述反应后的溶液中分离得到K3[Fe(C2O4)3]·3H2O晶体,测定所得产品的纯度:称取a g晶体溶于100 mL水中配成溶液,取20 mL溶液于锥形瓶中,用c mol·L-1的酸性K2Cr2O7标准溶液进行滴定(
 被还原为Cr3+),进行了三次平行实验,达到滴定终点时平均消耗标准溶液V mL,则所得产品的纯度为%(用含V、c、a的代数式表示)。
被还原为Cr3+),进行了三次平行实验,达到滴定终点时平均消耗标准溶液V mL,则所得产品的纯度为%(用含V、c、a的代数式表示)。
 和
和 的混合气体,通入
的混合气体,通入 、
、 、
、 的混合溶液,转化关系如图所示。下列描述正确的是( )
的混合溶液,转化关系如图所示。下列描述正确的是( )
 C . 氧化性强弱的顺序为
C . 氧化性强弱的顺序为 D . 转化过程中参加循环反应的离子只有
D . 转化过程中参加循环反应的离子只有 、
、

查阅资料:
①白磷(P4)外观为白色或浅黄色半透明性固体,暴露空气中在暗处产生绿色磷光和白烟,在湿空气中约40℃着火,不溶于水。
②H3PO2属于一元中强酸、强还原剂,加热到130℃时分解成磷酸和磷化氢。
回答下列问题:
-
(1) Ca10(PO4)6Fx中,x的值为。
-
(2) 将固体原料精细研磨的目的是, 如果固体原料恰好完全反应,所得还原产物与氧化产物的物质的量之比为。
-
(3) 从P4(g)和CO的气体混合物中分离得到P4 (s),应选择下列试剂中的_______(填标号)。A . 冷水 B . 热水 C . 空气
-
(4) P4(s)与足量氢氧化钾溶液反应的离子方程式为。
-
(5) H3PO2在130℃时分解的化学方程式为。
-
(6) 已知:11PH3+24CuSO4+12H2O=8Cu3P+3H3PO4+24H2SO4 , 该反应原理可用于磷化氢中毒时,口服硫酸铜溶液催吐、解毒。消耗1. 1mol PH3时转移电子数目为。
-
(1) 写出小苏打的化学式。
-
(2) 写出硫酸钠在水溶液中的电离方程式。
-
(3) 写出红热的铁与水蒸气反应的化学方程式。
-
(4) 下列物质中含原子数最多的是(填序号,下同)。
①0.5molH2O;②3.01×1023个CH4分子;③标准状况下,13.44LNH3;④21gCO和N2混合气体



