课题2 家用燃料的更新 知识点题库
目前我省不少城市居民所使用的燃料主要是管道煤气,有的地方已经开始使用天然气作为民用燃料.管道煤气的主要成分是CO、H2和少量烃类,天然气的主要成分是CH4 . 它们的燃烧反应如下:
2CO+O2 2CO2 2H2+O2
2CO2 2H2+O2 2H2O CH4+2O2
2H2O CH4+2O2 CO2+2H2O
CO2+2H2O
根据以上化学方程式判断:燃烧相同体积的管道煤气和天然气,消耗空气体积较大的是 因此燃烧管道煤气的灶具如需改烧天然气,灶具的改进方法是 进风口(填增大或减小),如不作改进可能产生的不良结果是
管道煤气中含有的烃类,除甲烷外,还有少量乙烷、丙烷、丁烷等,它们的某些性质见下表:
乙烷 | 丙烷 | 丁烷 | |
熔点(℃) | ﹣183.3 | ﹣189.7 | ﹣138.4 |
沸点(℃) | ﹣88.6 | ﹣42.1 | ﹣0.5 |
试根据以上某个关键数据解释冬天严寒的季节有时管道煤气火焰很小,并且呈断续状态的原因是


 O2(g)═CO(g)△H2 , 则△H2>△H1
C . 已知2H2(g)+O2(g)═2H2O(g)△H=﹣483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol
D . 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=﹣57.3 kJ/mol,则含20 g NaOH的稀溶液与稀盐酸完全中和,中和热为28.65 kJ/mol
O2(g)═CO(g)△H2 , 则△H2>△H1
C . 已知2H2(g)+O2(g)═2H2O(g)△H=﹣483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol
D . 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=﹣57.3 kJ/mol,则含20 g NaOH的稀溶液与稀盐酸完全中和,中和热为28.65 kJ/mol
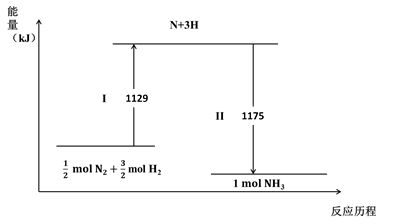
下列说法不正确的是( )
 2NH3(g) ΔH = –44 kJ·mol-1
D . 1mol N2(g)与3 mol H2(g)所具有的总能量比2 mol NH3(g) 所具有的总能量高
2NH3(g) ΔH = –44 kJ·mol-1
D . 1mol N2(g)与3 mol H2(g)所具有的总能量比2 mol NH3(g) 所具有的总能量高
| 选项 | 内容 | 结论 |
| A | H2O(g)变成H2O(l) | ΔS>0 |
| B | 硝酸铵溶于水可自发进行 | 因为ΔS<0 |
| C | 一个反应的ΔH>0,ΔS>0 | 反应一定不自发进行 |
| D | H2(g)+F2(g)=2HF(g) ΔH=-271 kJ·mol-1 ΔS=8 J·mol-1·K-1 | 反应在任意外界条件下均可自发进行 |
途径Ⅰ:C3H8(g)+5O2(g)= 3CO2(g)+4H2O(l) ΔH1=-a kJ·mol-1
途径Ⅱ:C3H8(g)= C3H6(g)+H2(g) ΔH2=+b kJ·mol-1
2C3H6(g)+9O2(g)= 6CO2(g)+6H2O(l) ΔH3=-c kJ·mol-1
2H2(g)+O2(g)= 2H2O(l) ΔH4=-d kJ·mol-1(a、b、c、d均为正值)
请回答下列问题:
-
(1) 判断等量的丙烷通过两种途径放出的热量,途径Ⅰ放出的热量(填“大于”“等于”或“小于”)途径Ⅱ放出的热量。
-
(2) 由于C3H8(g)= C3H6(g)+H2(g)的反应中,反应物具有的总能量(填“大于”“等于”或“小于”)生成物具有的总能量,那么在化学反应时,反应物就需要(填“放出”或“吸收”)能量才能转化为生成物,因此其反应条件是。
-
(3) b与a、c、d的数学关系式是。
 C . 铝热反应是放热反应
D . 吸热反应均需要加热才能发生
C . 铝热反应是放热反应
D . 吸热反应均需要加热才能发生
-
(1) 下列做法有助于能源“开源节流”的是 (填字母)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源
d.减少资源消耗,增加资源的重复使用和循环再生
-
(2) 金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,氧气充足时燃烧生成二氧化碳,反应中放出的热量如图所示。

①在通常状况下, (填“金刚石”或“石墨”)更稳定;石墨的燃烧热△H为。
②若12g金刚石在24g氧气中燃烧,生成气体36g,则该过程放出的热量为。
-
(3) 已知:N2、O2分子中化学键的键能分别是946mol·L-1、497mol·L-1 , N2(g)+O2(g)=2NO(g)△H=+180.0kJ·mol-1 , 则NO分子中化学键的键能为kJ·mol-1。
-
(4) 综合上述有关信息,请写出CO和NO反应生成两种无毒气体的热化学方程式:。



