第2节 电能转化为化学能—电解 知识点题库

选项 | M | N | P |
A | 锌 | 铜 | 稀硫酸 |
B | 铜 | 铁 | 稀盐酸 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |


-
(1) A2B的结构式为.
-
(2) CB2通入A2B2溶液中可被氧化为W,用W的溶液(体积为1L,假设变化前后溶液体积变化忽略不计)组装成原电池(如图1所示).
在b电极上发生的反应可表示为:PbO2+4H++SO42﹣+2e﹣=PbSO4+2H2O,则在a电极上发生的反应可表示为.电池工作一段时间后,a极消耗0.05mol Pb,则W的浓度由质量分数39% (密度1.3g/cm3)变为 mol/L.(小数点后保留两位)
-
(3) 金属元素E是中学化学常见元素,位于元素周期表的第四周期.该元素可与D形成ED2和ED3两种化合物.将E的单质浸入ED3溶液中(如图2甲所示),溶液由黄色逐渐变为浅绿色,该反应的离子方程式为.
-
(4) 依据(3)中的反应,可用单质E和石墨为电极设计一个原电池,则在该原电池工作时,单质E一极发生的反应可以表示为

-
(1) 若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则①电解池中X极上的电极反应式为.在X极附近观察到的实验现象是.
②Y电极上的电极反应式为.
③要使电解后溶液恢复到电解前的状态,则需加入(或通入).
-
(2) 如果要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是,电极反应式为.
②Y电极的材料是,电极反应式为.(说明:杂质发生的电极反应不必写出)
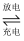 Li7Ti5 O12 。装置(Ⅱ)为电解池的示意图。当闭合K1 , 断开K2时,Fe电极附近溶液先变红。下列说法正确的是( )
Li7Ti5 O12 。装置(Ⅱ)为电解池的示意图。当闭合K1 , 断开K2时,Fe电极附近溶液先变红。下列说法正确的是( )
 2NaOH+Cl2↑+H2↑
B . 闭合K1 , 断开K2时,当0.1 mol Li+从A极区迁移到B极区,理论上Fe电极上产生的气体体积为1.12 L(标准状况下)
C . 取下锂离子电池充电,电极A为阳极,发生还氧化反应,电极上发生的电极反应式为:Li7Ti5 O12 -3e-= Li4Ti5 O12+3 Li+
D . 若开始时,断开K1 , 闭合K2 , 一段时间后,石墨电极附近显红色,则该电极反应为:2H++2e-=H2↑
2NaOH+Cl2↑+H2↑
B . 闭合K1 , 断开K2时,当0.1 mol Li+从A极区迁移到B极区,理论上Fe电极上产生的气体体积为1.12 L(标准状况下)
C . 取下锂离子电池充电,电极A为阳极,发生还氧化反应,电极上发生的电极反应式为:Li7Ti5 O12 -3e-= Li4Ti5 O12+3 Li+
D . 若开始时,断开K1 , 闭合K2 , 一段时间后,石墨电极附近显红色,则该电极反应为:2H++2e-=H2↑
-
(1) 科研人员设想用如图所示装置生产硫酸。
①上述生产硫酸的总反应方程式为,b 是极,b 电极反应式为,生产过程中H+向(填 a 或 b)电极区域运动。
②该小组同学反思原电池的原理,其中观点正确的是(填字母)。
A.原电池反应的过程中可能没有电子发生转移
B.原申池装置一定需要2个活泼性不同的金属电极
C.电极一定不能参加反应
D.氧化反应和还原反应可以拆开在两极发生
-
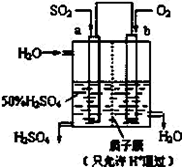
(2) CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜(只允许H+通过)质子交换膜左右两侧的溶液均为1L 2mol·L-1H2SO4溶液。燃料电池的结构示意图如下:
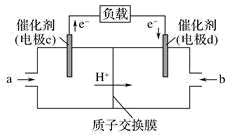
电池总反应为2CH3OH+3O2=2CO2+4H2O,c电极为(填“正极”或“负极”),c电极反应方程式为。当电池中有1mol e-发生转移时左右两侧溶液的质量之差为g (假设反应物耗尽,忽略气体的溶解)。

-
(1) 依据反应:2Ag+(aq)+Cu(s)
 Cu2+(aq)+2Ag(s)设计的原电池如下图甲所示。
Cu2+(aq)+2Ag(s)设计的原电池如下图甲所示。
①电极X的材料是;Y溶液可以是;
②银电极上发生的电极反应式是。
③在电池放电过程中,盛有饱和KCl琼脂溶胶的盐桥中,向CuSO4溶液一端扩散的离子是(填离子符号)。
-
(2) 金属腐蚀一般可分为化学腐蚀和电化学腐蚀,可以采用电化学手段进行防腐。
①炒菜的铁锅未及时清洗容易生锈。写出铁锅生锈过程的正极反应式。
②为了减缓某水库铁闸门被腐蚀的速率,可以采用下图乙所示的方案,其中焊接在铁闸门上的固体材料R可以采用(填写字母序号)。
A.铜 B.钠 C.锌 D.石墨
③图丙所示方案也可以减缓铁闸门的腐蚀速率,则铁闸门应连接直流电源的极。

-
(3) 蓄电池是一种可以反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应是:NiO2 + Fe + 2H2O
 Fe(OH)2 + Ni(OH)2。
Fe(OH)2 + Ni(OH)2。
①若此蓄电池放电时,该电池某一电极发生还原反应的物质是(填序号)。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
②该电池放电时,正极附近溶液的pH(填增大、减小、不变)
③充电时该电池阳极的电极反应式。


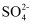 向Cu极移动
D . 若有1 mol电子流经导线,则可产生0.5 mol气体
向Cu极移动
D . 若有1 mol电子流经导线,则可产生0.5 mol气体

 。沥青混凝土可作为反应:
。沥青混凝土可作为反应: 
 的催化剂。下图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,
的催化剂。下图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,  的转化率与温度的关系。
的转化率与温度的关系。 
回答下列问题:
-
(1) 反应
 的
的 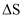 0(填“>”、“<”或“=”)。
0(填“>”、“<”或“=”)。
-
(2) 在a、b、c、d四点中,未达到平衡状态的是。
-
(3) a、b两点的平衡常数

 (填“>”、“<”或“=”)。已知c点时容器中
(填“>”、“<”或“=”)。已知c点时容器中  浓度为0.04
浓度为0.04 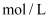 ,则50℃时,在
,则50℃时,在 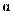 型沥青混凝土中
型沥青混凝土中  转化反应的平衡常数
转化反应的平衡常数 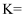 (用含x的代数式表示)。
(用含x的代数式表示)。
-
(4) 在均未达到平衡状态时,同温下不同型沥青混凝土中
 转化速率
转化速率 
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
-
(5) 工业上常用高浓度的
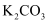 溶液吸收
溶液吸收  ,得到溶液X,再利用电解法使
,得到溶液X,再利用电解法使 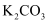 溶液再生,其装置示意图如图所示:
溶液再生,其装置示意图如图所示: 
①在阳极区发生的反应包括和
 ;
;②简述
 在阴极区再生的原理:。
在阴极区再生的原理:。
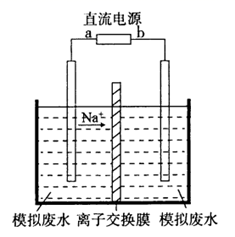
[已知阴极区域反应主要过程可表示为:H2O+e- =H*+OH- 、CH3CHO+2H* = CH3CH2OH (H*为活泼H)]

 D . 电子由镀层金属流向铁块
D . 电子由镀层金属流向铁块
 酸性溶液中加少量锌粒后,
酸性溶液中加少量锌粒后, 立即被还原成
立即被还原成 。某实验探究小组根据该实验事实设计了如图所示装置,盐桥选择氯化钾琼脂。下列有关说法正确的是( )
。某实验探究小组根据该实验事实设计了如图所示装置,盐桥选择氯化钾琼脂。下列有关说法正确的是( )
 移向右烧杯
C . 右侧烧杯中的电极反应式为:
移向右烧杯
C . 右侧烧杯中的电极反应式为: D . 左侧烧杯中电极上发生还原反应,溶液的红色逐渐褪去
D . 左侧烧杯中电极上发生还原反应,溶液的红色逐渐褪去
-
(1) 二氧化碳可催化加氢以制备甲醇:CO2(g)+3H2(g)
 CH3OH(g)+H2O(l)。已知氢气的燃烧热为285.8kJ/mol,甲醇(液态)的燃烧热为725.8kJ/mol,1mol液态甲醇转变为气态需吸热35.5kJ,计算以上甲醇制备反应的ΔH=。
CH3OH(g)+H2O(l)。已知氢气的燃烧热为285.8kJ/mol,甲醇(液态)的燃烧热为725.8kJ/mol,1mol液态甲醇转变为气态需吸热35.5kJ,计算以上甲醇制备反应的ΔH=。
-
(2) 当二氧化碳和氢气起始投料比n(CO2):n(H2)=1:2时,在0.5MPa、2.5MPa、5MPa压强下,H2.的平衡转化率α随温度变化如图所示:
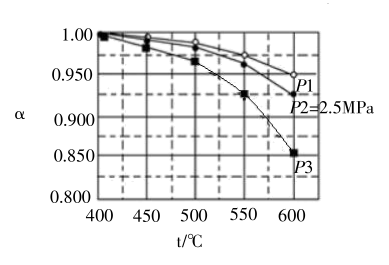
则反应在0.5MPa,550℃时的α=,判断的依据是,影响α的因素有(答出一点即可)。
-
(3) 将组成(物质的量分数)为0.2mol CO2(g),0.6mol H2(g)和0.1mol N2(g)通入反应器,按(1)中的反应原理,在温度T,恒定压强为p的条件下反应,平衡时若H2的转化率为50%,则CH3OH(g)的压强为,平衡常数Kp=(以分压表示,分压=总压×气体物质的量分数)。
-
(4) 根据相关文献报道,我国科学家设计了CO2熔盐捕获与电化学转化装置,原理如下图所示:

则b为电源极(填“正”或“负"),电路中转移0.4mol电子可捕获CO2的体积(标况下)为L。



