第3节 化学反应的速率 知识点题库
-
(1) 反应3Fe(S)+4H2O(g)═Fe3O4(s)+4H2(g)在一可变的容积的密闭容器中进行,试回答:
①增加Fe的量,其正反应速率的变化是(填增大、不变、减小,以下相同)
②将容器的体积缩小一半,其正反应速率.
③保持体积不变,充入N2使体系压强增大,其正反应速率.
④保持压强不变,充入N2使容器的体积增大,其正反应速率.
-
(2) 将等物质的量的A和B,混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)⇌xC(g)+2D(g),5min后测得c(D)=0.5mol•L﹣1 , c(A):c(B)=3:5,C的反应速率是0.1mol•L﹣1•min﹣1 .
①A在5min末的浓度是.②v(B)=. ③x=.
试管 | 温度 | 过氧化氢浓度 | 催化剂 |
A | 室温(25℃) | 12% | 有 |
B | 水浴加热(50℃) | 4% | 无 |
C | 水浴加热( 50℃) | 12% | 有 |
D | 室温(25℃) | 4% | 无 |
 2Z(气)一定达到化学平衡状态的是( )
2Z(气)一定达到化学平衡状态的是( ) ①X、Y、Z的物质的量之比为1∶2∶2 ②X、Y、Z的浓度不再发生变化 ③容器中的压强不再发生变化 ④单位时间内生成n mol Z,同时生成2n mol Y
下列判断正确的是( )
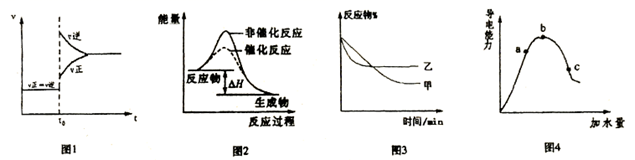
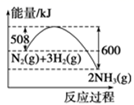
 3C(g)+2D(s) △H<0,达到平衡后升高温度成增大压强时的速率—时间变化图像
B . 图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C . 图3表示压强对可逆反应A(g)+B(g)
3C(g)+2D(s) △H<0,达到平衡后升高温度成增大压强时的速率—时间变化图像
B . 图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C . 图3表示压强对可逆反应A(g)+B(g)  3C(g)+D(s)的影响,乙的压强大
D . 图4表示冰醋酸加水稀释,导电能力的变化图像,其中b点醋酸电高程度最大
3C(g)+D(s)的影响,乙的压强大
D . 图4表示冰醋酸加水稀释,导电能力的变化图像,其中b点醋酸电高程度最大
 P(g)+W(g)。该可逆反应的平衡常数与温度的关系如表:
P(g)+W(g)。该可逆反应的平衡常数与温度的关系如表: | 温度/℃ | 300 | 500 | 700 | 900 |
| 平衡常数 | | | | |
回答下列问题:
-
(1) 温度为300℃时,在容器中加入0.5molM和0.5molN,4min时反应达到平衡。
①平衡时气体的总物质的量为mol。
②N的转化率为 %。
③若保持温度不变,再向容器中充入0.25molM和0.25molN,平衡将 (填“正向”逆向”或“不”)移动。
-
(2) 某温度下,将一定量的M和N充入该容器中,测得不同条件下反应过程中部分物质的物质的量变化情况如图所示。
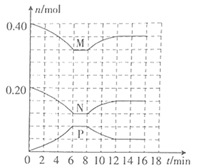
①生成物W在4~6min内的平均反应速率
 (W)= mol·L-1·min-1。
(W)= mol·L-1·min-1。②第8min时改变的反应条件可能是 (填标号)。
A.增大压强 B.减小压强 C.升高温度 D.降低温度
③若反应在第8min时,改变了反应的温度,则反应在第12min时,反应体系的温度为(填范围或数值)。
 M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表: | 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 900 | 0.10 | 0.15 | b |
下列说法错误的是( )

-
(1) 图中A、C分别表示、,E的大小对该反应的反应热有无影响?(填“有”或“无”)。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?,理由是。
-
(2) 图中ΔH=kJ/mol。
-
(3) 如果反应速率v(SO2)为0.05 mol·L-1·min-1 , 则v(O2)= mol·L-1·min-1 , v(SO3)=mol·L-1·min-1。
 ,反应过程中测定的部分数据见下表(表中t1<t2),下列说法错误的是( )
,反应过程中测定的部分数据见下表(表中t1<t2),下列说法错误的是( ) | 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
 mol/(L·min)
B . 保持其他条件不变,若起始时向容器中充入0.60 molCO和1.20 mol H2O (g),则到达平衡时n(CO2)=0.40 mol
C . 保持其他条件不变,若平衡后向容器中再充入0.40 mol CO和0.40 mol CO2 , 则平衡将向正反应方向移动
D . 温度升至800℃,上述反应的平衡常数为0.64,则该反应的正反应为放热反应
mol/(L·min)
B . 保持其他条件不变,若起始时向容器中充入0.60 molCO和1.20 mol H2O (g),则到达平衡时n(CO2)=0.40 mol
C . 保持其他条件不变,若平衡后向容器中再充入0.40 mol CO和0.40 mol CO2 , 则平衡将向正反应方向移动
D . 温度升至800℃,上述反应的平衡常数为0.64,则该反应的正反应为放热反应
-
(1) 已知:Ⅰ.C(s)+O2(g)=CO2(g)ΔH1=-393.5kJ·mol-1
Ⅱ.2C(s)+O2(g)=2CO(g)ΔH2=-221.0kJ·mol-1
Ⅲ.N2(g)+O2(g)=2NO(g)ΔH3=+180.5kJ·mol-1
利用高效催化剂处理汽车尾气中的NO和CO,发生反应:2NO(g)+2CO(g)=N2(g)+2CO2(g)。
①该反应正反应的活化能为EakJ·mol-1 , 则逆反应的活化能为 kJ·mol-1。
②该反应在下能自发进行(填“高温”或“低温”)。
③在2L恒容密闭容器中加入3molCO和2molNO,测得NO的转化率与温度(T)、时间(t)间的变化关系如图所示:则T2温度下,0~5min内用CO表示的平均反应速率v(CO)= ;T1温度下,上述反应的平衡常数K=L·mol-1;若在T1温度下,向平衡后的容器中再加入4molN2和amolNO,使平衡向右移动,则a的取值范围是。

-
(2) 有人利用反应C(s)+2NO(g)=N2(g)+CO2(g)ΔH=-34.0kJ·mol-1 , 用活性炭对NO进行吸附。现向恒容密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应。
①若为绝热容器,下列表示该反应达到平衡状态的是(填字母)。
A.混合气体的密度保持不变
B.混合气体的压强保持不变
C.NO和N2的消耗速率之比为1:2
D.混合气体中c(NO)=c(N2)
②若为恒温容器,经相同时间测得不同温度下NO的转化率随温度的变化如图所示:由图可知最高转化率B点对应温度为440℃,则A、B、C三点中点可能是对应温度下的平衡转化率;高于440℃时,NO的转化率降低的原因可能是平衡常数变小(即温度升高导致平衡逆向移动),也可能是。

 反应达到平衡后,升高温度,平衡常数K值变大
B .
反应达到平衡后,升高温度,平衡常数K值变大
B .  表示镁条放入盐酸中生成氢气速率随时间的变化
C .
表示镁条放入盐酸中生成氢气速率随时间的变化
C .  表示25 ℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1氨水,溶液的pH随加入盐酸体积的变化
D .
表示25 ℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1氨水,溶液的pH随加入盐酸体积的变化
D .  表示向Al2(SO4)3溶液中滴入NaOH溶液,生成Al(OH)3沉淀的量随NaOH溶液体积的变化
表示向Al2(SO4)3溶液中滴入NaOH溶液,生成Al(OH)3沉淀的量随NaOH溶液体积的变化
Ⅰ.TiCl4(g)+O2(g)  TiO2(s)+2Cl2(g) ΔH1=-178.4 kJ•mol-1
TiO2(s)+2Cl2(g) ΔH1=-178.4 kJ•mol-1
Ⅱ.2C(s)+O2(g)  2CO(g) ΔH2=-219.9 kJ•mol -1
2CO(g) ΔH2=-219.9 kJ•mol -1
请回答下列问题:
-
(1) TiCl4(g)与CO(g)反应生成 TiO2(s)、C(s)和氯气的热化学方程式为。
-
(2) 若反应Ⅰ的逆反应活化能表示为 E kJ•mol -1 , 则 E178.4(填“>”“<”或 “=”)。
-
(3) t℃时,向10 L恒容密闭容器中充入1 mol TiCl4和2 mol O2 , 发生反应Ⅰ.4 min 达到平衡时测得 TiO2 的物质的量为 0.2 mol。
①0~4 min 内,用 Cl2 表示的反应速率 v(Cl2)=。
②TiCl4的平衡转化率 α=。
③下列措施,既能加快反应速率又能增大TiCl4平衡转化率的是(填选项字母)。
A.缩小容器容积 B.加入催化剂 C.分离出部分TiO2 D.增大 O2 浓度 E.降低温度
④ t℃时,向10 L恒容密闭容器中充入4 mol TiCl4和一定量O2的混合气体,发生反应Ⅰ,两种气体的平衡转化率(α)与起始的物质的量之比
 的关系如图所示:
的关系如图所示:
能表示TiCl4平衡转化率的曲线为(填“L1”或 “L2”);M 点的坐标为。
-
(4) 也可以利用四氯化钛(TiCl4)水解制备TiO2 , 该反应的方程式为:。
① 用物质 A 表示的反应的平均速率为 0.3 mol·(L·s)-1
② 用物质 B 表示的反应的平均速率为 0.6 mol·(L·s)-1
③ 2 s 时物质 A 的转化率为30%
④ 2 s 时物质 B 的浓度为0.7 mol·L-1
其中正确的是( )

请回答:
-
(1) 白色沉淀D的化学式是。
-
(2) 组成X的3种元素是(填元素符号)。
-
(3) 固体X的溶液与盐酸反应的离子方程式是。
-
(4) 为探究外界条件对该化学反应速率的影响,设计以下三组实验:
实验方案
反应温度/℃
X的水溶液
稀盐酸






a
25
5
0.1
10
0.2
5
b
25
5
0.2
5
0.4
10
c
35
5
0.1
10
0.2
V
①表格中实验方案c的V=。
②设计实验方案a和b的目的是。
-
(1) Ⅰ.工业上可由氢气和氮气合成氨气。若用
 、
、 、
、 、
、 分别表示
分别表示 、
、 、
、 和催化剂,则在催化剂表面合成氨的过程如图所示:
和催化剂,则在催化剂表面合成氨的过程如图所示:
吸附后,能量状态最高的是(填序号)。
-
(2) 结合上述过程,一定温度下在固体催化剂表面进行NH3的分解实验,发现NH3的分解速率与浓度的关系如图所示。从吸附和解吸过程分析 , c0前反应速率增加的原因可能是;c0之后反应速率降低的原因可能是。

-
(3) Ⅱ.利用NH3在催化剂(V2O5—WO3/TiO2)作用下将NOx还原为N2是目前应用最为广泛的氮氧化物NOx的净化方法,其原理是:
主反应:4NH3(g)+4NO(g)+O2(g)
 4N2(g)+6H2O(g) ΔH1
4N2(g)+6H2O(g) ΔH1副反应:4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) ΔH2
2N2(g)+6H2O(g) ΔH2根据盖斯定律可得:4NH3(g)+6NO(g)
 5N2(g)+6H2O(g) ΔH3 , 则ΔH3=(用含ΔH1、ΔH2的式子表示)。
5N2(g)+6H2O(g) ΔH3 , 则ΔH3=(用含ΔH1、ΔH2的式子表示)。 -
(4) 催化剂V2O5—WO3/TiO2中的V2O5是活性组分。在反应器中以一定流速通过混合气[n(O2):n(NH3):n(NO)=71:1:1],在不同温度下进行该催化反应,V2O5的质量分数对单位时间内NO去除率的影响如图所示。

①从起始至对应A、B、C三点的平均反应速率由小到大的顺序为。
②V2O5的质量分数对该催化剂活性的影响是。
-
(5) 一定温度下,向1L恒容密闭容器(含催化剂)中投入1molNH3和1.5molNO,发生反应4NH3(g)+6NO(g)
 5N2(g)+6H2O(g)。达到平衡状态时,NO的转化率为60%,则平衡常数为mol·L-1(列出计算式即可)。
5N2(g)+6H2O(g)。达到平衡状态时,NO的转化率为60%,则平衡常数为mol·L-1(列出计算式即可)。
 2CO2+N2△H<0。
2CO2+N2△H<0。
-
(1) 为了提高该反应的速率和NO的转化率,采取的正确措施为____。A . 加催化剂同时升高温度 B . 加催化剂同时增大压强 C . 升高温度同时充入N2 D . 降低温度同时增大压强
-
(2) 该反应达到平衡时若增大压强,则混合气体的平均相对分子质量 (填“增大”、“减小”或“不变”)。
-
(3) 为研究上述反应,某学习小组在密闭容器中充入1molCO和1molNO,发生上述反应,实验测得平衡时NO的体积分数随温度、压强的关系如图所示。

某温度下的平衡状态D点,若同时采取缩小容器体积和降低温度,重新达到平衡状态时,可能到达图中A~G 点中的点;当压强为20MPa、温度为T2时的平衡常数Kp=MPa-1 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;保留2位有效数字)。