第3章 物质在水溶液中的行为 知识点题库
用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是( )
A .  B . c(H+)
C . c(H+)和c(OH﹣)的乘积
D . OH﹣的物质的量
B . c(H+)
C . c(H+)和c(OH﹣)的乘积
D . OH﹣的物质的量
 B . c(H+)
C . c(H+)和c(OH﹣)的乘积
D . OH﹣的物质的量
B . c(H+)
C . c(H+)和c(OH﹣)的乘积
D . OH﹣的物质的量
已知氢氧化钙和碳酸钙在水中分别存在下列溶解平衡:Ca(OH)2(s)⇌Ca2++2OH﹣ , CaCO3(s)⇌Ca2++CO  .在火力发电厂燃烧煤的废气中往往含有SO2、O2、N2、CO2等.为了除去有害气体SO2并变废为宝,常常用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏.
.在火力发电厂燃烧煤的废气中往往含有SO2、O2、N2、CO2等.为了除去有害气体SO2并变废为宝,常常用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏.
 .在火力发电厂燃烧煤的废气中往往含有SO2、O2、N2、CO2等.为了除去有害气体SO2并变废为宝,常常用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏.
.在火力发电厂燃烧煤的废气中往往含有SO2、O2、N2、CO2等.为了除去有害气体SO2并变废为宝,常常用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏.
-
(1) 写出上述两个反应的化学方程式:
①SO2与CaCO3悬浊液反应:
②SO2与Ca(OH)2悬浊液反应:
-
(2) 试说明用熟石灰的悬浊液而不用澄清石灰水的理由.
-
(3) 在英国进行的一项研究结果表明:高烟囱可以有效地降低地表面SO2浓度.在二十世纪的60~70年代的10年间,由发电厂排放的SO2增加了35%,但由于建造高烟囱的结果,地表面SO2浓度却降低了30%之多.请你从全球环境保护的角度,分析这种方法是否可取?简述理由,危害.
《奔跑吧兄弟》是一档热播的娱乐节目,其中蕴含着许多化学知识,其中一期节目,队员用水枪将酚酞溶液喷射到对方的“名牌”上,立即变红色.事先浸泡“名牌”的溶液可能是( )
A . 白酒
B . 纯碱溶液
C . 食盐溶液
D . 柠檬酸
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
实验编号 | HA物质的量浓度 (mol•L﹣1) | NaOH物质的量浓度 (mol•L﹣1) | 混合溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | c | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=9 |
-
(1) 不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸.
-
(2) 不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2(选填“是”或“否”).混合液中离子浓度c(A﹣)与 c(Na+)的大小关系是.
-
(3) 丙组实验结果分析,HA是酸(选填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是.
-
(4) 丁组实验所得混合溶液中由水电离出的c(OH﹣)=mol•L﹣1 . 写出该混合溶液中下列算式的精确结果(不需做近似计算).c(Na+)﹣c(A﹣)=mol•L﹣1 c(OH﹣)﹣c(HA)=mol•L﹣1 .
下列说法不正确的是( )
A . pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(M+)>c(H+)>c(OH-)>c(A-)
B . 中和相同体积、相同物质的量浓度的①硫酸,②盐酸和③醋酸所需相同浓度的NaOH溶液的体积关系:V1>V2=V3
C . 稀氨水中部分粒子的浓度大小关系:c(NH3·H2O)>c(OH-)>c(NH4+ )>c(H+)
D . 1mol/LNaX和1mol/LNaY两种盐溶液中c(X-)=c(Y-)+c(HY),则HX为强酸
25 ℃时,调节2.0×10-3 mol/L氢氟酸水溶液的pH(忽略体积变化),得到c(HF)、c(F-) 与溶液pH的变化关系如图所示。请结合图中信息回答下列问题:

-
(1) HF电离平衡常数的表达式:Ka=。室温下,向HF溶液中滴加NaOH溶液至pH=3.4时,c(F-)∶c(HF) =。HF的电离常数值为。
-
(2) 将4.0×10-3 mol/L的HF溶液与4.0×10-4 mol/L CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生:
。[ 已知Ksp(CaF2)=1.5×10-10 ]
某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),已知电离平衡常数:CH3COOH>H2CO3>C6H5OH >HCO  ,其中错误的是( )
,其中错误的是( )
A . pH相等的四种溶液:a.CH3COONab.C6H5ONac.NaHCO3d.NaOH,则四种溶液的溶质的物质的量浓度由小到大顺序为:d<b<c<a
B . pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
C . pH=2的一元酸和pH=12的二元强碱等体积混合:c(OH-)≤c(H+)
D . pH=4浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+)
某无色溶液含有下列离子中的若干种:H+、NH4+、Fe3+、Ba2+、Al3+、CO32-、Cl-、OH-、NO3-。向该溶液中加入铝粉,只放出H2 , 则溶液中能大量存在的离子最多有( )
A . 4种
B . 5种
C . 6种
D . 7种
在给定条件的水溶液中不能大量共存的粒子组是( )
A . 在碱性溶液中:Na+、K+、 
 B . 既能溶解Al(OH)3又能溶解H2SiO3的溶液中:Na+、
B . 既能溶解Al(OH)3又能溶解H2SiO3的溶液中:Na+、  、ClO-、
、ClO-、  C . 含Fe3+的溶液:Na+、Mg2+、
C . 含Fe3+的溶液:Na+、Mg2+、  、I-
D . CH3COOH溶液:
、I-
D . CH3COOH溶液:  、Cl-、Cu2+、
、Cl-、Cu2+、 

 B . 既能溶解Al(OH)3又能溶解H2SiO3的溶液中:Na+、
B . 既能溶解Al(OH)3又能溶解H2SiO3的溶液中:Na+、  、ClO-、
、ClO-、  C . 含Fe3+的溶液:Na+、Mg2+、
C . 含Fe3+的溶液:Na+、Mg2+、  、I-
D . CH3COOH溶液:
、I-
D . CH3COOH溶液:  、Cl-、Cu2+、
、Cl-、Cu2+、 
某无色稀溶液X中,可能含有下表所列离子中的某几种。
| 阴离子 | CO |
| 阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂Y体积(V)的关系如图所示,下列说法正确的是( )
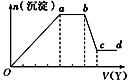
A . 若Y是盐酸,则Oa段转化为沉淀的离子(上表中,下同)只有[Al(OH)4]-
B . 若Y是盐酸,则溶液中可能含有的阳离子是Al3+
C . 若Y是NaOH溶液,则bc段反应的离子方程式为Al(OH)3+OH-=[Al(OH)4]-
D . 若Y是NaOH溶液,则X溶液中只存在四种离子,是Al3+、Fe3+、NH4+、Cl-
下列离子能大量共存的是( )
A . K+、Mg2+、NH  、SO
、SO  B . Na+、Al3+、Cl-、OH-
C . Ba2+、Fe2+、NO
B . Na+、Al3+、Cl-、OH-
C . Ba2+、Fe2+、NO  、CO
、CO  D . H+、K+、CO
D . H+、K+、CO  、NO
、NO 
 、SO
、SO 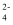 B . Na+、Al3+、Cl-、OH-
C . Ba2+、Fe2+、NO
B . Na+、Al3+、Cl-、OH-
C . Ba2+、Fe2+、NO  、CO
、CO 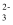 D . H+、K+、CO
D . H+、K+、CO 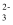 、NO
、NO 
在25℃时,用蒸馏水稀释1mol/L氨水至0.01mol/L,随溶液的稀释,下列各项中始终保持增大趋势的是( )
A .  B . c(H+)·c(OH-)
C .
B . c(H+)·c(OH-)
C .  D . c(OH-)
D . c(OH-)
 B . c(H+)·c(OH-)
C .
B . c(H+)·c(OH-)
C .  D . c(OH-)
D . c(OH-)
常温下,下列各组离子因发生氧化还原反应不能大量共存的是( )
A . 在含大量Fe3+溶液中:  、Na+、Cl-、SCN-
B . pH=1的溶液中:Fe3+、K+、I-、Cl-
C . 能与金属铝反应生成氢气的溶液中:
、Na+、Cl-、SCN-
B . pH=1的溶液中:Fe3+、K+、I-、Cl-
C . 能与金属铝反应生成氢气的溶液中:  、Al3+、
、Al3+、  、Cl-
D . 在强碱溶液中:Na+、K+、Cl-、
、Cl-
D . 在强碱溶液中:Na+、K+、Cl-、 
 、Na+、Cl-、SCN-
B . pH=1的溶液中:Fe3+、K+、I-、Cl-
C . 能与金属铝反应生成氢气的溶液中:
、Na+、Cl-、SCN-
B . pH=1的溶液中:Fe3+、K+、I-、Cl-
C . 能与金属铝反应生成氢气的溶液中:  、Al3+、
、Al3+、  、Cl-
D . 在强碱溶液中:Na+、K+、Cl-、
、Cl-
D . 在强碱溶液中:Na+、K+、Cl-、 
25℃0.1mol•L-1的BA溶液中各种微粒浓度随pH的变化关系如图所示。下列说法错误的是( )

A . HA的电离常数的数量级为10-5
B . 25℃时,BA的溶液pH=7
C . pH由7到14,水解程度A->B+
D . 该体系中c(HA)+c(A-)=c(BOH)+c(B+)
设 为阿伏加德罗常数,下列说法正确的是( )
为阿伏加德罗常数,下列说法正确的是( )
 为阿伏加德罗常数,下列说法正确的是( )
为阿伏加德罗常数,下列说法正确的是( )
A . 25℃时,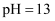 的
的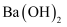 溶液中含有的
溶液中含有的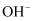 数目为
数目为 B .
B .  催化氧化生成
催化氧化生成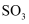 , 得到
, 得到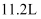 标准状况下的
标准状况下的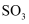 时转移的电子数为
时转移的电子数为 C .
C .  与
与 所含质子数均为
所含质子数均为 D . 含
D . 含 碳原子的金刚石中含有碳碳单键的数目为
碳原子的金刚石中含有碳碳单键的数目为
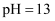 的
的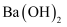 溶液中含有的
溶液中含有的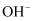 数目为
数目为 B .
B .  催化氧化生成
催化氧化生成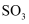 , 得到
, 得到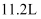 标准状况下的
标准状况下的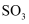 时转移的电子数为
时转移的电子数为 C .
C .  与
与 所含质子数均为
所含质子数均为 D . 含
D . 含 碳原子的金刚石中含有碳碳单键的数目为
碳原子的金刚石中含有碳碳单键的数目为
某小组进行以下探究。实验①:Mg条与盐酸-KCl溶液(pH=3.08)反应;实验②:Mg条与0.001 
 溶液(pH=3.08)反应。两个实验所用的Mg条(打磨过)足量且表面积相同。测得溶液pH随时间变化的曲线如下图所示。两个实验过程中均观察到有无色气体产生,实验②中没有检测到
溶液(pH=3.08)反应。两个实验所用的Mg条(打磨过)足量且表面积相同。测得溶液pH随时间变化的曲线如下图所示。两个实验过程中均观察到有无色气体产生,实验②中没有检测到 和Fe。
和Fe。

 溶液(pH=3.08)反应。两个实验所用的Mg条(打磨过)足量且表面积相同。测得溶液pH随时间变化的曲线如下图所示。两个实验过程中均观察到有无色气体产生,实验②中没有检测到
溶液(pH=3.08)反应。两个实验所用的Mg条(打磨过)足量且表面积相同。测得溶液pH随时间变化的曲线如下图所示。两个实验过程中均观察到有无色气体产生,实验②中没有检测到 和Fe。
和Fe。
下列说法不正确的是( )
A . 无色气体为 B . 0~200秒,实验②产生氢气的速率比实验①慢
C . 实验①②中pH发生突变与Mg和水的反应有关
D . 400秒时,
B . 0~200秒,实验②产生氢气的速率比实验①慢
C . 实验①②中pH发生突变与Mg和水的反应有关
D . 400秒时, :实验②>实验①
:实验②>实验①
 B . 0~200秒,实验②产生氢气的速率比实验①慢
C . 实验①②中pH发生突变与Mg和水的反应有关
D . 400秒时,
B . 0~200秒,实验②产生氢气的速率比实验①慢
C . 实验①②中pH发生突变与Mg和水的反应有关
D . 400秒时, :实验②>实验①
:实验②>实验①
 是实验室常用试剂。25℃时,下列相关说法正确的是( )
是实验室常用试剂。25℃时,下列相关说法正确的是( )
A . pH均为4的 溶液和NH4Cl溶液,水的电离程度相同
B . 向0.1mol/L
溶液和NH4Cl溶液,水的电离程度相同
B . 向0.1mol/L  溶液中加入少量的水,溶液中
溶液中加入少量的水,溶液中 增大
C . 0.2mol
增大
C . 0.2mol  与0.1mol NaOH溶于水配制成100mL的缓冲溶液,测得pH=5.5,则该缓冲溶液中:
与0.1mol NaOH溶于水配制成100mL的缓冲溶液,测得pH=5.5,则该缓冲溶液中: D .
D .  溶液与固体
溶液与固体 反应,将产生的气体通入苯酚钠溶液中,溶液变出现浑浊。说明酸性:碳酸>苯酚
反应,将产生的气体通入苯酚钠溶液中,溶液变出现浑浊。说明酸性:碳酸>苯酚
 溶液和NH4Cl溶液,水的电离程度相同
B . 向0.1mol/L
溶液和NH4Cl溶液,水的电离程度相同
B . 向0.1mol/L  溶液中加入少量的水,溶液中
溶液中加入少量的水,溶液中 增大
C . 0.2mol
增大
C . 0.2mol  与0.1mol NaOH溶于水配制成100mL的缓冲溶液,测得pH=5.5,则该缓冲溶液中:
与0.1mol NaOH溶于水配制成100mL的缓冲溶液,测得pH=5.5,则该缓冲溶液中: D .
D .  溶液与固体
溶液与固体 反应,将产生的气体通入苯酚钠溶液中,溶液变出现浑浊。说明酸性:碳酸>苯酚
反应,将产生的气体通入苯酚钠溶液中,溶液变出现浑浊。说明酸性:碳酸>苯酚
完成下列问题。
-
(1) 常温下,有
 相同、体积相同的醋酸和盐酸两种溶液,采取以下措施:
相同、体积相同的醋酸和盐酸两种溶液,采取以下措施:①加等浓度的NaOH溶液至恰好中和,所需NaOH溶液的体积:醋酸(填>、=或<)盐酸。
②分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是(填字母:①表示盐酸,②表示醋酸)
a.
 b.
b. c.
c. d.
d.
-
(2) 常温条件下,某浓度的氨水中存在平衡,
 , 如想增大
, 如想增大 的浓度而不增大
的浓度而不增大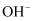 的浓度,应采取的措施是____(填字母)。
A . 适当升高温度 B . 加入
的浓度,应采取的措施是____(填字母)。
A . 适当升高温度 B . 加入 固体
C . 通入
固体
C . 通入 D . 通入少量氯化氢气体
D . 通入少量氯化氢气体
-
(3) 常温下
 的电离常数为
的电离常数为 , 则
, 则 的
的 溶液的
溶液的 。
。
-
(4) 常温下,用
 氨水滴定10mL浓度均为
氨水滴定10mL浓度均为 的HCl和
的HCl和 的混合液,下列说法正确的是____。
A . 在氨水滴定前,HCl和
的混合液,下列说法正确的是____。
A . 在氨水滴定前,HCl和 的混合液中
的混合液中 B . 当滴入氨水10mL时,
B . 当滴入氨水10mL时, C . 当滴入氨水20mL时,
C . 当滴入氨水20mL时, D . 当溶液呈中性时,氨水滴入量大于20mL,
D . 当溶液呈中性时,氨水滴入量大于20mL,
-
(5) 常温时,
 溶液中离子浓度大小顺序为:。
溶液中离子浓度大小顺序为:。
分类是学习化学的重要方法,以物质的元素组成和化学性质视角对物质进行科学分类,可体现化学学科独有的魅力。有下列物质:①SO2 ②水银 ③Na2O2固体 ④稀硫酸 ⑤碳酸钠固体 ⑥酒精 ⑦熔融的KNO3 ⑧蔗糖 ⑨Fe(OH)3胶体
请回答下列问题:
-
(1) 上述物质中属于酸性氧化物的是(填序号,下同)。
-
(2) 上述物质中能导电的纯净物是。
-
(3) 上述物质中属于电解质的是。
-
(4) 将④逐滴加入⑨中的现象是。
-
(5) 制备⑨的离子反应方程式是。
离子反应在物质分离、提纯、鉴定等方面有广泛的应用。实验室里需要纯净的氯化钠溶液,但现在只有混有硫酸钠、碳酸氢铵的氯化钠固体。某学生设计了如图方案,请回答下列问题。

已知:操作①中发生的化学反应方程式为: ;操作②和③中,试剂1是
;操作②和③中,试剂1是 溶液,试剂2是
溶液,试剂2是 溶液,且二者均过量。
溶液,且二者均过量。
-
(1) 写出
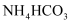 在水溶液中的电离方程式:;
在水溶液中的电离方程式:;
-
(2) 加入试剂1发生时反应的离子方程式:;
-
(3) 试剂2的目的是;
-
(4) 如何检验NaCl溶液产品中的
 ?
?
最近更新



