主题2 物质性质及反应规律的研究 知识点题库
(1)人们在对烷烃分子空间结构的研究中发现某一系列的烷烃分子只有一种一卤代物.如:
这一系列烷烃具有一定的规律性,当一种烃分子中的﹣H全部被﹣CH3取代后,它的一卤代物异构体数目不变.
①请写出这一系列烷烃分子式的通式 。
②人们在研究中发现另一系列烷烃分子也只有一种一卤取代物,请写出它们分子式的通式 。
(2)化合物A、B和C互为同分异构体.它们的元素分析数据为:碳92.3%,氢7.7%.1molA在氧气中充分燃烧产生179.2LCO2(标准状况).A是芳香烃,分子中所有的原子共平面;B是具有两个支链的链状化合物,分子中只有两种不同化学环境的氢原子,为非极性分子;C是饱和烃,分子中碳原子的化学环境完全相同.
①A、B和C的分子式为 。
②画出A、B和C的结构简式:
A ;B :C 。


时间 实验序号 | 1 | 10 | 20 | 30 | 40 | 50 | 60 | |
1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
-
(1) 实验1中,在10~20min时间内,以A的速率表示的平均反应速率为mol•L﹣1•min﹣1
-
(2) 实验2中,A的初始浓度c2=mol•L﹣1 , 反应经20min就达到平衡,可推测实验2中还隐含的条件是.
-
(3) 设实验3的化学反应速率为v3 , 实验1的化学反应速率为v1 , 则v3v1(填“>”“=”或“<”),且c31.0mol•L﹣1(填“>”“=”或“<”).
-
(4) 比较实验4和实验1,可推测该反应的正反应是反应(填“吸热”或“放热”),理由是.


-
(1) D电极上发生的电极反应:.左杯中发生反应的化学方程式为:.
-
(2) 在右杯中观察到的现象是:.
②确定分子式:如图是该有机物的质谱图,则其相对分子质量为 ;分子式为 ;

③结构式的确定:经测定,该有机物在核磁共振氢谱中出现四个峰,其氢原子个数比为6:1:2:1;该有机物与金属钠反应产生氢气;则A的结构简式为 。
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 向待测溶液中先滴加几滴氯水,然后滴加KSCN溶液 | 溶液变红 | 待测溶液中含有Fe2+ |
B | 向KMnO4酸性溶液中滴加乙二酸 | 溶液褪色 | 乙二酸具有还原性 |
C | 向AgNO3溶液中滴加过量氨水 | 得到澄清溶液 | Ag+与NH3·H2O能大 量共存 |
D | 向10mL0.1mol·L-1Na2S溶液中滴入2mL0.1 mol·L-1ZnSO4溶液,再加入0.1 mol·L-1CuSO4溶液 | 开始有白色沉淀生成;后有黑色沉淀生成 | Ksp(CuS)<Ksp(ZnS) |
-
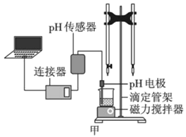
(1) 为了探究c(H+)对反应速率的影响,进行实验:

10mL 1mol· L-1 KI溶液5滴淀粉溶液
序号
加入试剂
变色时间
Ⅰ
10mL蒸馏水
长时间放置,未见明显变化
Ⅱ
10mL 0.1mol· L-1H2SO4溶液
放置3min后,溶液变蓝
Ⅲ
10mL 0.2mol· L-1H2SO4溶液
放置1min后,溶液变蓝
Ⅳ
10mL 0.1mol· L-1K2SO4溶液
长时间放置,未见明显变化
① 写出实验Ⅱ发生反应的离子方程式 。
② 实验Ⅰ~Ⅲ所得结论:。
③ 增大实验Ⅱ反应速率还可以采取的措施 。
④ 实验Ⅳ的作用是。
-
(2) 为探究c(H+)除了对反应速率影响外,是否还有其他影响,提出假设:
ⅰ. 增大c(H+),增强O2的氧化性;
ⅱ. 增大c(H+),。
小组同学利用下图装置设计实验方案,对假设进行验证。

序号
溶液a
溶液b
现象
Ⅴ
10mL 1mol· L-1 KI溶液
10mL H2O
10mL 0.1mol·L-1K2SO4溶液
10mLH2O
指针未见偏转
Ⅵ
10mL 1mol· L-1 KI溶液
10mL H2O
10mL 0.1mol·L-1K2SO4溶液
1mL 0.2mol·L-1H2SO4溶液
9mL H2O
指针
偏转
Ⅶ
X
10mL 0.1mol·L-1K2SO4溶液
10mL 0.2mol·L-1H2SO4溶液
Y
Ⅷ
Z
10mL 0.1mol·L-1K2SO4溶液
10mLH2O
指针未见偏转
通过实验证实假设ⅰ合理,将表中空白处的试剂或现象补充完整。
X ;Y ;Z 。
 在容积为10L的密闭容器中进行。起始时
在容积为10L的密闭容器中进行。起始时  和
和  均为0.20mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。下列说法不正确的是( )
均为0.20mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。下列说法不正确的是( ) 
 B . 实验a条件下,用浓度表示的平衡常数为100
C . 该反应的
B . 实验a条件下,用浓度表示的平衡常数为100
C . 该反应的  D . 比较实验a、c可判断升高温度反应速率加快
D . 比较实验a、c可判断升高温度反应速率加快
-
(1) 制造肥皂的主要原料是(填序号,下同)。
-
(2) 用于配制福尔马林的是。
-
(3) 属于天然高分子化合物,可用于纺织工业的是。
-
(4) 和可用于制造酚醛树脂。
-
(5) 能用于制造烈性炸药 TNT 的是,该反应的化学方程式是。
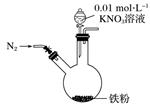
|
实验步骤 |
实验现象 |
|
①打开弹簧夹,缓慢通入N2 |
|
|
②加入0.01 mol·L-1的酸性KNO3溶液100 mL |
铁粉部分溶解,溶液呈浅绿色;铁粉不再溶解后,剩余铁粉表面附着少量白色物质 |
|
③反应停止后,拔掉橡胶塞,将圆底烧瓶取下 |
烧瓶内气体的颜色没有发生变化 |
|
④将剩余固体过滤 |
表面的白色物质变为红褐色 |
-
(1) 通入N2并保持后续反应均在N2氛围中进行的实验目的是。
-
(2) 白色物质是(写化学式)。
-
(3) 为了探究滤液的成分,该同学进一步设计了下述实验:
实验步骤
实验现象
①取部分滤液于试管中,向其中加入KSCN溶液
溶液无变化
②将上述溶液分为两份,一份中滴入氯水,另一份中滴加稀硫酸
两份溶液均变为红色
③另取部分滤液于试管中,向其中加入浓NaOH溶液并加热,在试管口放置湿润的红色石蕊试纸
有气体生成,该气体使湿润的红色石蕊试纸变蓝
(ⅰ)根据以上实验现象,可以判断滤液中存在 (填离子符号)。
(ⅱ)步骤②中滴加稀硫酸后溶液会由浅绿色变成红色,请用离子方程式解释其原因:(写第一步反应)。
(ⅲ)步骤③中生成气体的离子方程式为。
| 选项 | 目的 | 操作 |
| A | 除去Cu粉中混有的CuO | 加入稀硝酸,过滤、洗涤、干燥 |
| B | 探究温度对Fe3+水解程度的影响 | 向25 mL冷水和沸水中分别滴入5滴饱和FeCl3溶液,比较溶液颜色 |
| C | 证明甲苯中的甲基能够活化苯环 | 分别取甲苯和苯与酸性KMnO4溶液反应,观察酸性KMnO4溶液的褪色情况 |
| D | 证明非金属性:Cl>S | 向Na2S溶液中滴加新制氯水,观察实验现象 |

-
(1) A的结构简式为
 ,用系统命名法命名A:。
,用系统命名法命名A:。
-
(2) 某烃的分子式为
 ,核磁共振氢谱图中显示一个峰,则该烃的一氯代物有种,该烃的结构简式为。
,核磁共振氢谱图中显示一个峰,则该烃的一氯代物有种,该烃的结构简式为。
-
(3) 阿司匹林又叫乙酰水杨酸,具有镇疼解热功效,合成反应如下:

回答下列问题
①下列有关水杨酸的说法,正确的是(填标号)。
A.能与溴水发生取代和加成反应
B.是一种二元弱酸
C.1mol水杨酸最多能与
 反应
反应D.遇
 溶液显紫色
溶液显紫色②乙酰水杨酸的核磁共振氢谱有组吸收峰,其核磁共振氢谱有4组吸收峰的一种同分异构体的结构简式是。
③乙酰水杨酸与足量
 溶液反应的化学方程式是。
溶液反应的化学方程式是。

请回答:
-
(1) I中不加热时无明显现象是因为。
-
(2) 加热I试管后说明有SO2气体生成的实验现象是。
-
(3) V中出现少量浑浊是因为I中发生了反应(用化学方程式表示)
-
(4) 下列说法正确的是_______A . 反应前,检查装置I的气密性,需在II中加水至浸没导管,微热I中试管,若II中导管口有气泡溢出,就可以说明装置I气密性良好 B . 装置I的优点是可通过抽动铁、碳合金丝控制反应的进行 C . 取下试管III并不断振荡,试管中出现浑浊,是因为生成了BaSO4 D . 试管IV中KMnO4溶液褪色,说明SO2具有氧化性
 +2H2O采用饱和Ca(OH)2溶液浸杂卤石制备 K2SO4工艺流程如下:
+2H2O采用饱和Ca(OH)2溶液浸杂卤石制备 K2SO4工艺流程如下: 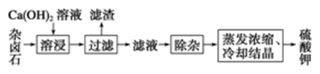
回答下列问题:
-
(1) 滤渣的主要成分有和以及未溶杂卤石。
-
(2) 用化学平衡移动原理解释Ca(OH)2溶液能溶解杂岗石浸出K+的原因
-
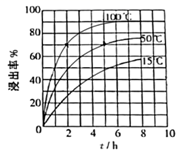
(3) “溶浸”中,K+的浸出率结果如图所示。由图可知,当K+的浸出率为70%时。可以采用的实验条件为
-
(4) “除杂”中,先加入溶液,经搅拌等操作后,过滤,再加入溶液,调滤液pH至中性。
-
(5) 以可溶性碳酸盐为溶浸剂,溶浸过程中会发生: CaSO4(s)+CO
 (ag)⇌CaCO3(s)+ SO
(ag)⇌CaCO3(s)+ SO  (ag)
(ag) 已知298K时,Ksp(CaCO3)=2.80×10-9 , Ksp(CaSO4)=4.90×10-5.此温度下,该反应的平衡常数K=。
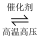 2NH3的微观历程如图所示。下列说法正确的是( )
2NH3的微观历程如图所示。下列说法正确的是( ) 

 C . 生成1mol高铁酸盐,II室溶液质量理论上增大56g
D . 工作时,I室和II室溶液的pH均增大
C . 生成1mol高铁酸盐,II室溶液质量理论上增大56g
D . 工作时,I室和II室溶液的pH均增大



