活动1 认识盐类的水解 知识点题库
下列各项中的两个量,其比例为2∶1的是
A . 硫酸铵固体中n(NH4+)与n(SO42-)
B . 相同温度下,0.02 mol/L的醋酸溶液与0.01 mol/L 醋酸溶液中的c(H+)
C . 液面均在“0”刻度时,50 mL酸式滴定管和25 mL酸式滴定管内所盛溶液的体积
D . 40℃时pH=7的(NH4)2SO4与NH3·H2O的混合液中,c(NH4+)与c(SO42-)
下列说法正确的是( )
A . 室温下,0.001 mol•L﹣1的醋酸中由水电离的c(H+)=10﹣11mol•L﹣1
B . Na2CO3溶液中存在c(Na+)+c(H+)═c(OH﹣)+a c(X)+b c(Y),若X为HCO3﹣ , 则b=2
C . 某温度下,浓度均为0.01mol•L﹣1的盐酸和氢氧化钠溶液的pH分别为2和12
D . 向0.1mol•L﹣1氯化铵溶液滴加几滴浓盐酸,c(NH4+)减小,PH增大
下面关于水解应用的说法错误的是( )
A . 用热水溶解纯碱能够提高去油污的效果
B . 配制氯化铁溶液时滴加几滴稀盐酸可以防止氢氧化铁形成
C . 硫酸铵和草木灰混合施用到农田可以增强肥效
D . 盐碱地(含NaCl、Na2CO3)施加适量石膏可以降低土壤的碱性
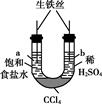
下列过程或现象与盐类水解无关的是( )
A . 纯碱溶液除油污
B . 浓硫化钠溶液有臭味
C . 加热氯化铁溶液颜色变深
D . 铁在潮湿的环境下生锈
简答题
-
(1) 盐碱地因含较多的NaCl、Na2CO3 , 使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有CaSO4 , 微溶于水)来降低土壤的碱性.用离子方程式和必要的文字解释CaSO4的作用.
-
(2) SOCl2是一种无色或淡黄色液体,遇水剧烈反应得到二氧化硫和氯化氢,是一种常用的脱水剂.将SOCl2与FeCl3•6H2O混合并加热,可得到无水FeCl3 , 得到无水FeCl3的化学方程式为.
二氧化硫、一氧化氮是大气污染物.吸收二氧化硫和一氧化氮,获得Na2S2O4和NH4NO3产品的流程图如图1(Ce为铈元素):
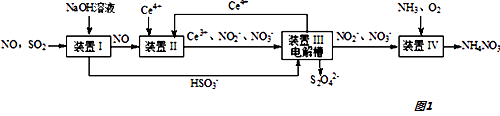
-
(1) 装置Ⅰ中生成HSO3﹣的离子方程式为.
-
(2) 含硫各微粒(H2SO3、HSO3﹣和SO32﹣)存在于二氧化硫与氢氧化钠溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图2所示.
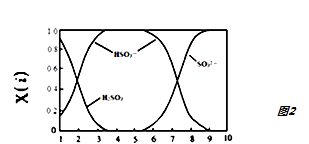
①下列说法正确的是(填字母序号).
A. pH=8时,溶液中c(HSO3﹣)<c(SO32﹣)
B. pH=7时,溶液中 c(Na+)=c(HSO3﹣)+c(SO32﹣)
C. 为获得尽可能纯的NaHSO3 , 可将溶液的pH控制在4﹣5左右
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液降低的原因:.
-
(3) 装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3﹣、NO2﹣ , 写出生成NO3﹣的离子方程式.
为了配制NH4+的浓度与Cl﹣的浓度之比为1:1的溶液,可在NH4Cl溶液中加入( )
A . 适量的HCl
B . 适量的NaCl
C . 适量的氨水
D . 适量的NaOH
若用AG表示溶液的酸度,其表达式为:AG=lg[  ]。室温下,实验室里用0.10 mol/L 的盐酸溶液滴定10 mL 0.10 mol/L MOH溶液,滴定曲线如图所示:下列说法正确的是( )
]。室温下,实验室里用0.10 mol/L 的盐酸溶液滴定10 mL 0.10 mol/L MOH溶液,滴定曲线如图所示:下列说法正确的是( )
 ]。室温下,实验室里用0.10 mol/L 的盐酸溶液滴定10 mL 0.10 mol/L MOH溶液,滴定曲线如图所示:下列说法正确的是( )
]。室温下,实验室里用0.10 mol/L 的盐酸溶液滴定10 mL 0.10 mol/L MOH溶液,滴定曲线如图所示:下列说法正确的是( ) 
A . 该滴定过程可选择酚酞作为指示剂
B . C点加入盐酸的体积为10mL
C . 若B点加入的盐酸溶液体积为5mL,所得溶液中:c(M+)+2c(H+)=c(MOH)+2c(OH−)
D . 滴定过程中从A点到D点溶液中水的电离程度逐渐增大
为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后,在向滤液中加入适量的盐酸,这种试剂是( )
A . NH3·H2O
B . NaOH
C . Na2CO3
D . MgCO3
下列溶液呈碱性的是( )
A . NH4NO3
B . (NH4)2SO4
C . KCl
D . K2CO3
下列化学方程式中,属于水解反应的是( )
A . CH3COOH+ H2O  CH3COO-+H3O+
B . HS-+H2O
CH3COO-+H3O+
B . HS-+H2O  S2-+ H3O+
C . CO32-+ H2O
S2-+ H3O+
C . CO32-+ H2O  HCO3-+OH-
D . CO2+H2O
HCO3-+OH-
D . CO2+H2O  HCO3-+ H+
HCO3-+ H+
 CH3COO-+H3O+
B . HS-+H2O
CH3COO-+H3O+
B . HS-+H2O  S2-+ H3O+
C . CO32-+ H2O
S2-+ H3O+
C . CO32-+ H2O  HCO3-+OH-
D . CO2+H2O
HCO3-+OH-
D . CO2+H2O  HCO3-+ H+
HCO3-+ H+
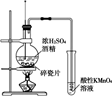
下列设计的实验方案能达到实验目的的是( )
A . 制取无水AlCl3:将AlCl3溶液加热蒸干并灼烧
B . 除去锅炉水垢中含有的CaSO4:先用Na2CO3溶液处理,然后再加酸去除
C . 证明氨水中存在电离平衡:向滴有酚酞的氨水中加入少量NH4Cl固体,溶液红色变深
D . 配制FeCl3溶液时为防止溶液浑浊常加入少量稀硫酸
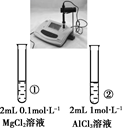
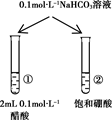
下列实验的现象与结论相对应的是( )
| A | B | C | D | |
| 实验 | | | | |
| 现象 | 一段时间后,a管液面高于b管液面 | 酸性KMnO4溶液褪色 | pH计测得①中pH大于②中pH | 试管①中有大量气泡,试管②中无现象 |
| 结论 | a管发生吸氧腐蚀,b管发生析氢腐蚀 | 有乙烯生成可以使酸性KMnO4溶液褪色 | 金属性:Mg>Al | 酸性:醋酸>碳酸>硼酸 |
A . A
B . B
C . C
D . D
某同学探究溶液的酸碱性对FeCl3水解平衡的影响,实验方案如下:配制50 mL 0.001 mol/L FeCl3溶液、50mL对照组溶液x,向两种溶液中分别滴加1滴1 mol/L HCl溶液、1滴1 mol/L NaOH 溶液,测得溶液pH随时间变化的曲线如下图所示。

下列说法错误的是( )
A . 依据M点对应的pH,说明Fe3+发生了水解反应
B . 对照组溶液x的组成可能是0.003 mol/L KCl
C . 依据曲线c和d说明Fe3+水解平衡发生了移动
D . 通过仪器检测体系浑浊度的变化,可表征水解平衡移动的方向
下列离子方程式中,属于水解反应的是( )
A . HCOOH+H2O  HCOO−+H3O+
B . CO32-+2H2O
HCOO−+H3O+
B . CO32-+2H2O  H2CO3+2OH-
C . Fe3++3H2O
H2CO3+2OH-
C . Fe3++3H2O  Fe(OH)3↓+3H+
D . HS-+H2O
Fe(OH)3↓+3H+
D . HS-+H2O  H2S+OH-
H2S+OH-
 HCOO−+H3O+
B . CO32-+2H2O
HCOO−+H3O+
B . CO32-+2H2O  H2CO3+2OH-
C . Fe3++3H2O
H2CO3+2OH-
C . Fe3++3H2O  Fe(OH)3↓+3H+
D . HS-+H2O
Fe(OH)3↓+3H+
D . HS-+H2O  H2S+OH-
H2S+OH-
部分弱电解质的电离平衡常数如下表,下列说法错误的是( )
| 弱电解质 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 (25 ℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
A . 结合质子的能力:CO 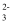 >CN->HCO
>CN->HCO  >HCOO-
B . 可发生2CN-+ H2O +CO2 = 2HCN + CO
>HCOO-
B . 可发生2CN-+ H2O +CO2 = 2HCN + CO 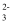 C . 等浓度NaCN和NaHCO3溶液中:c(Na+)>c(HCO
C . 等浓度NaCN和NaHCO3溶液中:c(Na+)>c(HCO  )>c(CN-)>c(OH-)>c(H+)
D . 相同浓度HCOOH和HCN溶液,HCOOH的pH更小
)>c(CN-)>c(OH-)>c(H+)
D . 相同浓度HCOOH和HCN溶液,HCOOH的pH更小
 >CN->HCO
>CN->HCO  >HCOO-
B . 可发生2CN-+ H2O +CO2 = 2HCN + CO
>HCOO-
B . 可发生2CN-+ H2O +CO2 = 2HCN + CO  C . 等浓度NaCN和NaHCO3溶液中:c(Na+)>c(HCO
C . 等浓度NaCN和NaHCO3溶液中:c(Na+)>c(HCO  )>c(CN-)>c(OH-)>c(H+)
D . 相同浓度HCOOH和HCN溶液,HCOOH的pH更小
)>c(CN-)>c(OH-)>c(H+)
D . 相同浓度HCOOH和HCN溶液,HCOOH的pH更小
常温下,下列说法正确的是( )
A . 0.1mol/LNH4Cl溶液加水稀释,  减小
B . 已知Ka(HA)=1×10-7 , 则0.1mol/LHA溶液中的c(H+)约为1×10-3mol/L
C . pH=4的NaHSO3溶液,c(H2SO3)>c(SO
减小
B . 已知Ka(HA)=1×10-7 , 则0.1mol/LHA溶液中的c(H+)约为1×10-3mol/L
C . pH=4的NaHSO3溶液,c(H2SO3)>c(SO  )
D . 等浓度的下列溶液中c(NH
)
D . 等浓度的下列溶液中c(NH  )大小顺序为:(NH4)2SO4>NH4HSO4>NH4Cl
)大小顺序为:(NH4)2SO4>NH4HSO4>NH4Cl
 减小
B . 已知Ka(HA)=1×10-7 , 则0.1mol/LHA溶液中的c(H+)约为1×10-3mol/L
C . pH=4的NaHSO3溶液,c(H2SO3)>c(SO
减小
B . 已知Ka(HA)=1×10-7 , 则0.1mol/LHA溶液中的c(H+)约为1×10-3mol/L
C . pH=4的NaHSO3溶液,c(H2SO3)>c(SO  )
D . 等浓度的下列溶液中c(NH
)
D . 等浓度的下列溶液中c(NH  )大小顺序为:(NH4)2SO4>NH4HSO4>NH4Cl
)大小顺序为:(NH4)2SO4>NH4HSO4>NH4Cl
下列溶液一定呈中性的是( )
A . pH=7的溶液
B . Kw=1.0×10-14的溶液
C . c(H+)>c(OH-)的溶液
D . c(H+)=c(OH-)的溶液
电离平衡常数是衡量弱电解质电离程度的量。已知如表数据(25℃):
|
化学式 |
电离平衡常数 |
|
HCN |
K=4.9×10-10 |
|
CH3COOH |
K=1.8×10-5 |
|
H2CO3 |
K1=4.4×10-7 , K2=4.7×10-11 |
-
(1) 25℃,等浓度的三种溶液(a.NaCN溶液、b.Na2CO3溶液、c.CH3COONa溶液)的pH由大到小的顺序为。(填写序号)
-
(2) 25℃时,向NaCN溶液中通入少量CO2 , 所发生反应的化学方程式为。
-
(3) 现有浓度为0.02mol/L的HCN与0.01mol/LNaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是_____。A . c(H+)>c(OH-) B . c(H+)<c(OH-) C . c(H+)+c(HCN)=c(OH-) D . c(HCN)+c(CN-)=0.01mol/L
-
(4) 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表
实验编号
HA物质的量浓度(mol·L-1)
NaOH物质的量浓度(mol·L-1)
反应后溶液pH
a
0.1
0.1
pH=8
b
c
0.2
pH=7
①从a组情况分析,HA是强酸还是弱酸。
②b组情况表明,c0.2(选填“大于”、“小于”或“等于”)。该混合液中离子浓度c(A-)c(Na+)(选填“大于”、“小于”或“等于”)。
③a组实验所得混合溶液中由水电离出的c(OH-)=mol/L。写出该混合溶液中下列算式的精确结果。c(Na+)-c(A-)=mol/L。
-
(5) 100℃时,水的离子积为1×10-12 , 将pH=11的NaOH溶液V1L与pH=2的H2SO4溶液V2L均匀混合后,若所得混合溶液的pH=10,则V1:V2为
-
(6) HA为弱酸,在室温下,用蒸馏水稀释0.01mol/L HA溶液时,下列呈减小趋势的是_____。(填字母)A .
 B .
B .  C . 溶液中c(H+)和c(OH-)的乘积
D . 溶液中c(A-)·c(HA)的值
E . 水的电离程度
C . 溶液中c(H+)和c(OH-)的乘积
D . 溶液中c(A-)·c(HA)的值
E . 水的电离程度
对食物的酸碱性判断正确的是( )
A . 西瓜是酸性食物
B . 牛肉是碱性食物
C . 大米、面粉是碱性食物
D . 鸡蛋是酸性食物
最近更新