主题3 物质的检测 知识点题库
①氢氧化亚铁在空气中最终变为灰绿色;
②淀粉溶液遇单质碘变为蓝色;
③向硫酸铁溶液中加入KSCN变为红色
④新制氯水久置后变为无色;
⑤无水硫酸铜吸收水蒸气变成浅绿色;
⑥品红溶液通入过量二氧化硫后褪色.
-
(1) 准确称取4.1g烧碱样品.将样品配成250mL待测液,需要的仪器除了小烧杯、玻璃棒、量筒还需要.
-
(2) 取10.00mL待测液,用量取.
-
(3) 用0.2010mol•L﹣1标准盐酸滴定待测烧碱溶液,甲基橙做指示剂,滴定时左手旋转滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视的现象时即到达滴定终点.
-
(4) 根据下列数据,计算待测烧碱溶液的纯度:.(保留四位有效数字)
滴定次数
待测液体积
(mL)
标准盐酸体积(mL)
滴定前读数(mL)
滴定后读数(mL)
第一次
10.00
0.50
20.40
第二次
10.00
0.10
22.10
第三次
10.00
4.00
24.10
-
(5) 以下操作会造成测量结果偏高的是
①用蒸馏水冲洗锥形瓶;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外;
③读数时,滴定前仰视,滴定后俯视;
④装标准液之前,没有用标准液润洗滴定管.
 (提示:环丁烷
(提示:环丁烷  可简写成
可简写成 ![]() )
)
-
(1) A的分子式是
-
(2) A与溴的四氯化碳溶液反应的化学方程式(有机物用结构简式表示)
-
(3) A与乙醇反应的化学方程式(有机物用结构简式表示)是
-
(4) 17.4g A与足量碳酸氢钠溶液反应,计算生成二氧化碳的体积(标准状况)
-
(5) A在浓硫酸作用下加热可得到B(B的结构简式为
 ),其反应类型是。
),其反应类型是。
-
(6) 苯与硝酸反应生成硝基苯的方程式
-
(7) 蔗糖水解的方程式
已知:CH3CH=CHCH2CH3  CH3COOH+CH3CH2COOH
CH3COOH+CH3CH2COOH

请回答下列问题:
-
(1) 香豆素分子中的官能团的名称为,步骤II→III的反应类型为。
-
(2) 有机物III的结构简式为,在上述转化过程中,设计反应步骤II→III的目的是。
-
(3) 下列关于有机物I、II、III、IV的叙述中正确的是________(选填序号)。A . 可用FeCl3溶液来鉴别II和III B . IV中核磁共振氢谱共有4种峰 C . I、II、III均可使溴的四氯化碳溶液褪色 D . 1molI最多能和5molH2发生加成反应
-
(4) 写出水杨酸与过量NaHCO3溶液反应的化学方程式。
-
(5) 化合物IV有多种同分异构体,符合下列两个条件的芳香族同分异构体共有种。
①遇氯化铁溶液发生显色反应
②能发生水解反应和银镜反应
其中,核磁共振氢谱共有5种吸收峰,且吸收峰面积比为1:2:2:2:1同分异构体的结构简式为。
-
(1) 工业合成氨是制取氮肥的基础。合成氨反应中,反应物 N2 的结构式是,产物NH3 的电子式是。
-
(2) 某小组在实验室模拟以 NH3 为原料, 制备少量硝态氮肥 Ca(NO3)2 , 转化途径如下(转化所需试剂及条件已略去)。
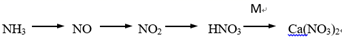
①NO→NO2 的现象是, NO2→HNO3 的化学方程式为。
②将HNO3 转化为 Ca(NO3)2 , 列举两种不同类别的化合物 M(写化学式) 。
-
(3) ①NH4HCO3 是一种铵态氮肥,需阴凉处保存,原因是(写化学方程式)。
②实验室检验某化肥是铵态氮肥,检验过程中发生反应的离子方程式为。
-
(4) 过渡施用氮肥将导致大气中NH3含量增高,加剧雾霾的形成。(NH4)2SO4是雾霾的成分之一,其形成过程如下图所示(转化所需试剂及条件已略去)
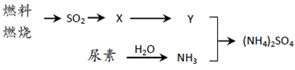
①X可能是SO3 或,Y是。
②尿素CO(NH2)2是一种常用有机氮肥,缓慢与 H2O 发生非氧化还原反应释放出NH3和另外一种气体,该反应的化学方程式为。

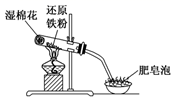
请回答下列问题:
-
(1) Ⅰ.该反应的化学方程式是,硬质试管中湿棉花的作用是: .
-
(2) 该同学对反应后硬质试管中固体物质的组成提出了如下假设。
假设1:只有Fe;
假设2:只有(填化学式);
假设3:既有Fe也有Fe3O4。
-
(3) 为了验证反应后硬质试管中固体物质的组成,该同学进行了定量研究:反应前固体物质的质量为5.6g,反应后固体物质的质量为6.6g。从数据分析,反应后硬质试管中固体物质的组成成分为。
-
(4) Ⅱ.长期放置的FeSO4溶液易被氧化而变质,某兴趣小组进行了如下实验:
A.设计实验检验FeSO4溶液的变质程度
实验方案
实验现象
实验结论
步骤1
取待检测液于试管中,向其中滴加KSCN溶液
FeSO4溶液部分变质
步骤2
取待检测液于试管中,向其中滴加K3[Fe(SCN)6]溶液
①将上述方案补充完整
②步骤2涉及的离子反应方程式是。
③若要使变质的FeSO4复原,方法是。(写离子反应方程式)

已知:Sb2O3难溶于H2SO4;Bi2Oз+2H2SO4=2Bi(OH)SO4↓+H2O。
回答下列问题:
-
(1) “粉碎”的目的是。
-
(2) ①若氧化剂为H2O2 , 溶解Cu2O反应的离子方程式为;
②温度对铜浸出率的影响如图所示。

工业浸出时一般选择70℃~80℃,温度过低时铜浸出率低的原因是;
-
(3) “操作I”为减压过滤。与常压过滤比较,其优点是;
-
(4) ①“浸出渣II”的主要成分是SbOCl、;
②写出SbCl3水解生成SbOCl的化学方程式:;
-
(5) “铜浸出液”用如图旋流式电解装置电解。

①钛涂层柱的电极反应式是;
②若“铜浸出液”中含铜92.16g·L-1 , 选择合适条件进行旋流电解。取电解后溶液25.00mL,加入足量KI溶液充分反应,以淀粉为指示剂,用0.1000mol·L-1的标准液Na2S2O3滴定,反应为:2Cu2++4I-=2CuI↓+I2、I2+2
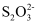 =2I-+
=2I-+  ,消耗18.00mL标准液。旋流电解铜回收率是。(用质量分数表示,保留一位小数)。
,消耗18.00mL标准液。旋流电解铜回收率是。(用质量分数表示,保留一位小数)。


 溶液褪色
D .
溶液褪色
D .  该物质最多消耗
该物质最多消耗 



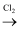

 (CH3)2Si(OH)2
(CH3)2Si(OH)2 

 硅橡胶
C . 用乙烯合成乙酸:
硅橡胶
C . 用乙烯合成乙酸:  D . 用乙醇合成乙二醇:
D . 用乙醇合成乙二醇: 

 B .
B .  该物质能与
该物质能与 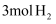 发生加成反应
C . 该物质的水解产物均能使酸性高锰酸钾溶液褪色
D . 该物质分子中所有碳原子不可能共平面
发生加成反应
C . 该物质的水解产物均能使酸性高锰酸钾溶液褪色
D . 该物质分子中所有碳原子不可能共平面
 B . 取一根洁净的铂丝,在酒精灯火焰上灼烧至无色,然后蘸取少量待测液,置于火焰上灼烧,火焰呈黄色,则溶液中一定含有氯化钠
C . 取适量待测液于试管中,滴入足量KSCN溶液,无明显现象,再滴入适量氯水,溶液变为血红色,则原待测液中一定含有Fe3+
D . 于试管中加热某固体纯净物样品,试管口出现小水珠,则该样品中一定存在结晶水
B . 取一根洁净的铂丝,在酒精灯火焰上灼烧至无色,然后蘸取少量待测液,置于火焰上灼烧,火焰呈黄色,则溶液中一定含有氯化钠
C . 取适量待测液于试管中,滴入足量KSCN溶液,无明显现象,再滴入适量氯水,溶液变为血红色,则原待测液中一定含有Fe3+
D . 于试管中加热某固体纯净物样品,试管口出现小水珠,则该样品中一定存在结晶水
 既是一种化工产品,同时也是重要的化工原料。以氨气作原料可制备叠氮化钠(NaN3)可用于合成抗生素头孢菌素药物和汽车安全气囊的气源。
既是一种化工产品,同时也是重要的化工原料。以氨气作原料可制备叠氮化钠(NaN3)可用于合成抗生素头孢菌素药物和汽车安全气囊的气源。
-
(1) Ⅰ.实验室中制备NaN3分2步进行:
①制备氨基钠:
 , 装置如下图。已知氨基钠极易与水剧烈反应生成
, 装置如下图。已知氨基钠极易与水剧烈反应生成 , 且易被空气氧化。
, 且易被空气氧化。
②制备叠氮化钠:将得到的
 与
与 在210~220℃的条件下反应生成
在210~220℃的条件下反应生成 和
和 。
。盛放浓氨水的仪器名称为,B的作用是。
-
(2) 连接好装置并检查装置的气密性后,装入试剂,然后应先。
a.向A中加入浓氨水 b.加热装置C
-
(3) 若无B装置,C中生成的氨基钠会发生的化学方程式为。
-
(4) D装置中长导管不伸入液面的目的是。
-
(5)
 可由
可由 (熔点169.6℃)在185~200℃分解制得,最好选用的气体发生装置是(填标号)。
(熔点169.6℃)在185~200℃分解制得,最好选用的气体发生装置是(填标号)。a.
 b.
b.  c.
c. 
-
(6) Ⅱ.测定的纯度
精确称量
 样品,设计如图乙所示装置,连接好装置后使锥形瓶倾斜,使小试管中的样品与M溶液接触,测量产生的气体体积从而测定其纯度(不考虑溶剂的挥发)。已知:
样品,设计如图乙所示装置,连接好装置后使锥形瓶倾斜,使小试管中的样品与M溶液接触,测量产生的气体体积从而测定其纯度(不考虑溶剂的挥发)。已知: (其他产物略),反应中放出大量的热。
(其他产物略),反应中放出大量的热。
常温下测得产生气体的体积为45.00mL (
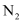 的密度为1.400g/L),计算
的密度为1.400g/L),计算 样品的纯度为(质量分数)。
样品的纯度为(质量分数)。



