9.2 无素周期表 知识点题库
有X、Y两种元素的原子序数均不大于20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中a、m、n均为正整数)。下列说法正确的是
A . 若X(OH)n为强碱,则Y(OH)n也一定为强碱
B . 若HaXOn为强酸,则X的氢化物溶于水一定显酸性
C . 若X元素形成的单质是X2 , 则Y元素形成的单质也一定是Y2
D . 若Y的最高正价为+m , 则X的最高正价也一定为+m
下列离子中半径最大的是( )
A . Na+
B . Mg2+
C . O2﹣
D . F﹣
第七周期为不完全周期,若将来发现的元素把这一周期全部排满,则下列有关第七周期元素的推论可能错误的是( )
A . 第七周期排满时有32种元素,全部是放射性元素
B . 第七周期排满时最后一种元素的单质常温常压下是气体
C . 第七周期ⅦA族元素的原子序数为117,是一种金属元素
D . 第七周期ⅢA族元素的氢氧化物与Al(OH)3具有相似的化学性质
下列物质递变规律不能用元素周期律解释的是( )
A . 非金属性:C>Si
B . 碱性:NaOH>Mg(OH)2
C . 酸性:H2SO3>H2CO3
D . 还原性:HI>HBr
在1﹣﹣18号元素中,原子半径最小的是,能形成的最稳定的氢化物是,最高价氧化物对应水化物碱性最强的碱是,高价氧化物对应水化物酸性最强的酸是,第三周期中原子半径最小的非金属与金属性最强的金属形成的化合物的电子式为.(以上均用元素符号表示)
氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3 , 请回答下列问题:
①比较Na3N中两种微粒的半径r(Na+) r(N3﹣)(填“>”“<”或“=”),
②Na3N与水反应属于反应(填“氧化还原”或“非氧化还原”);
③Na3N与盐酸反应生成两种盐的化学式为;
④写出化合物Na3N的电子式:.
含有元素硒(Se)的保健品已开始进入市场.已知它与氧同族,与钾同周期.则下列关于硒的叙述中,正确的是( )
A . 金属性比钾强
B . 最高价氧化物的化学式是SeO3
C . 高价含氧酸的酸性:H2SeO4>H2SO4
D . 氢化物稳定性:H2Se>H2O
X、Y、Z三种短周期元素在周期表中的位置如图,X通过共用三对电子形成X2分子,下列说法不正确的是( )
X |
|
|
| Y | Z |
A . 化合物XZ3中各原子均满足8电子的稳定结构
B . X、Y、Z三种元素形成的含氧酸都是强酸
C . 常温下,Z单质可与Y的氢化物发生置换反应
D . Z的气态氢化物比Y的气态氢化物更加稳定
根据已学物质结构与性质的有关知识,回答下列问题:
-
(1) 请写出第三周期元素中p轨道上有3个未成对电子的元素符号:,某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4 , 该元素的名称是.
-
(2) 根据价层电子对互斥理论推测下列离子或分子的空间立体构型:H3O+,BF3.
-
(3) 向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解,得到深蓝色的透明溶液,写出有关反应的离子方程式、.
-
(4) 金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.则体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为;若两种晶体中最邻近的铁原子间距离相同,则体心立方晶胞和面心立方晶胞的密度之比为.

下列元素中,原子半径最大的是( )
A . C
B . N
C . Si
D . Cl
已知 33As 与 35Br 是位于同一周期的主族元素,下列说法正确的是( )
A . 原子半径: As > P > Si
B . 酸性: H3AsO4>H2SO4>H3PO4
C . 热稳定性: HCl>AsH3>HBr
D . 还原性: As3->S2->Cl-
短周期元素X、Y、Z、W的原子序数依次递增,其原子的最外层电子数之和为15。X与Y、Z、W位于相邻周期,Z最外层电子数与周期数相等,W的一种氧化物是主要的大气污染物。下列叙述正确的是( )
A . 原子半径的大小顺序:r (W) > r (Z) > r (Y) > r (X)
B . 最高价氧化物对应的水化物的碱性:Y > Z
C . X、W的简单气态氢化物都易溶于水
D . Z的最高价氧化物对应的水化物一定能溶于X的最高价氧化物对应的水化物
已知X、Y、Z、W四种元素是短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W是该元素所在周期原子半径最大的元素,W原子的质子数等于Y、Z原子的最外层电子数之和。Y与X形成的分子中有3个共价键,该分子中含有10个电子。Z原子最外层电子数是次外层电子数的3倍,试判断:
-
(1) X、Z两种元素的元素符号为X,Z。
-
(2) 由以上元素两两形成的化合物中:溶于水显碱性的气态氢化物的电子式为。
-
(3) ①由X、Y、Z所形成的常见离子化合物是(写化学式)。
②该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为。
③化合物WY3的晶体结构中含有的化学键为(选填序号)。
A.只含离子键
B.只含共价键
C.既含离子键又含共价键
④X与W形成的化合物与水反应生成X2 , 其中水作(填“氧化剂”或“还原剂”)。
-
(4) 用电子式表示化合物W2Z的形成过程:。
短周期元素W、X、Y、Z的原子序数依次增大。其中Y与Z为金属元素,p、q是它们中的部分元素组成的化合物,r是W的单质。s是Z的单质,能溶解于Y的最高价氧化物的水化物溶液中。这些物质间的转化关系为  。下列说法正确的是( )
。下列说法正确的是( )
 。下列说法正确的是( )
。下列说法正确的是( )
A . q只含有共价键
B . 原子半径:X<W<Z<Y
C . W的最简单氢化物的热稳定性比X的强
D . Y分别与W、X形成的化合物都能使紫色石蕊溶液最终变蓝
下列事实不能作为元素的金展性或非金属性强弱判断依据的是( )
A . Zn和Fe分别与稀硫酸反应,判断金属性强弱:Zn>Fe
B . Mg投入CuCl2溶液中能置换出铜,Ba 投入CuCl2溶液中不能置换出铜,判断金属性强弱:Mg>Ba
C . 酸性:H2SiO3<HClO4 , 判断非金属性强弱:Cl> Si
D . 依据O2、S分别与H2反应的难易程度,判断非金属性强弱:O>S
A、B、C、D、E、F六种元素,它们的核电荷数均小于18,且原子序数逐渐增大。已知:A、C、F三种原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水。D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个。请回答下列问题:
-
(1) 写出D的名称,E的最高价氧化物的水化物的分子式。
-
(2) 画出B元素的原子结构示意图。
-
(3) 若构成F元素的一种核素的中子数为18,写出该核素的表示符号。
-
(4) A与C、C与F元素最高价氧化物的水化物反应的离子方程式依次为:、。
一种由短周期主族元素组成的化合物,在厨房里经常用到,其结构如图所示,所含元素W、X、Y、Z的原子序数依次增大,Z的核外电子数等于W、X、Y最外层电子数之和。下列有关叙述正确的是( )

A . 非金属性:Y>W>X
B . 简单离子半径:Z>Y>W
C . Z2Y2既能与W2Y反应,也能与XY2反应
D . 该化合物中各原子最外层均为8电子结构
A、B、C、X、Y、Z、E为前四周期元素,且原子序数依次增大。A原子核外有三个能级,且每个能级上的电子数相等,C原子成对电子数是未成对电子数的3倍,X、Y、Z、E是位于同一周期的金属元素,X、E 原子的最外层电子数均为1,Y有“生物金属”之称,Y4+和氩原子的核外电子排布相同,Z原子核外电子的运动状态数目是最外层电子数的14倍。用元素符号回答下列问题:
-
(1) B 原子的电子排布式为,Y原子的价电子轨道表示式为,Z2+的价电子排布式为。
-
(2) E元素位于元素周期表第周期族,属于区元素。
-
(3) ①A、B、C三种元素的第一电离能由小到大的顺序为。
②A、C 元素简单气态氢化物的稳定性:>(用分子式表示),原因是。
③AC2的电子式为。
关于元素周期表说法正确的是( )
A . 除ds区外,各区的名称来自按照构造原理最后填入电子的能级的符号
B . 最外层电子数为2的元素都分布在s区
C . 第二周期元素中,第一电离能介于B、N之间的有1种元素
D . 第四周期的金属元素从左到右,元素的金属性依次减弱
LDFCB是电池的一种电解质,该电解质阴离子由同周期元素原子W、X、Y、Z构成,结构如图,Y的最外层电子数等于X的核外电子总数,下列说法正确的是( )
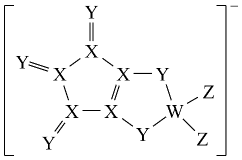
A . 同周期元素第一电离能小于Y的有5种
B . 简单氢化物的还原性:X<Y
C . 四种元素中原子半径最大的是W
D . 四种元素形成的单质中Y的氧化性最强
最近更新



