第十三章 检验一些无机化合物 知识点题库
①Na+、Fe2+、H+、NO  ②K+、NH
②K+、NH  、HCO
、HCO  、OH﹣
、OH﹣
③S2﹣、SO  、Cl﹣、OH﹣④Fe2+、Fe3+、Cu2+、SO
、Cl﹣、OH﹣④Fe2+、Fe3+、Cu2+、SO 
⑤K+、Na+、AlO  、HCO
、HCO  ⑥Ca2+、Na+、SO
⑥Ca2+、Na+、SO  、CO
、CO  .
.
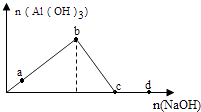
| 离子 | Na+ | Ba2+ | | NO3- | Cl- |
| 浓度(mol/L) | 1.0×10 | 1.0×10 | y | 2.0×10 | 2.0×10 |
则 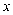 和y可能是( )
和y可能是( )
 B . K+:1.0×10
B . K+:1.0×10  C . SO42-:1.0×10
C . SO42-:1.0×10  D . I-:2.0×10
D . I-:2.0×10 

称取研细的黄铜矿样品1.150g煅烧,生成Cu、Fe2O3 、FeO和SO2气体,实验后取d中溶液的1/5置于锥形瓶中,用0.01mo1/L标准碘溶液进行滴定,初读数为0.10mL,末读数如图2所示.完成下列填空:
-
(1) 装置c的作用是。
-
(2) 上述反应结束后,仍需通一段时间的空气,其目的是。
-
(3) 滴定时,标准碘溶液所耗体积为mL;用化学方程式表示滴定的原理:。
-
(4) 计算该黄铜矿的纯度。
-
(5) 工业上利用黄铜矿冶炼铜产生的炉渣(含Fe2O3 、FeO、SiO2、Al2O3)可制备Fe2O3.
选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液
所选试剂为;证明炉渣中含有FeO的实验现象为:。
-
(1) I. 化合物甲和化合物乙的混合粉末是汽车安全气囊中存放的化学物质,经组成分析,确定该混合粉末仅含 Na、Fe、N、O 四种元素。为研究安全气囊工作的化学原理,进行以下实验操作:
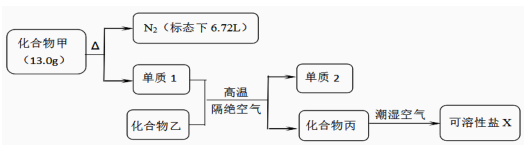
请回答下列问题:
工业上冶炼单质 2 的化学方程式为
-
(2) 若化合物丙在空气中转化为碳酸氢盐,则反应的化学方程式为
-
(3) 化合物甲可用下列方法制备:30℃时,将水合肼(N2H4•H2O)、亚硝酸甲酯(CH3ONO)、
NaOH 混合,充分反应后先回收得到 CH3OH,母液降温结晶,过滤得到化合物甲。写出用该法制备化合物甲的化学反应方程式
-
(4) II. 晶体硅是一种重要的非金属材料。实验室用 SiHCl3 与过量 H2 反应制备纯硅的装置如下(热源及夹持装置略)。制备纯硅的主要反应为:SiHCl3+H2 = Si(纯)+3HCl
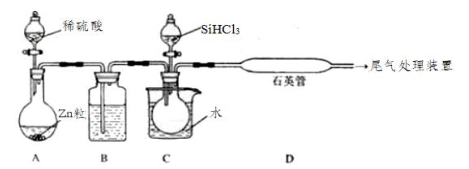
已知①SiHCl3 沸点 33.0℃,上述反应在 1000~1100℃进行;
②SiHCl3 能与 H2O 强烈反应,在空气中易自燃。请回答下列问题:
下列说法不正确的是
A . 装置B 中的溶液可以是浓硫酸 B . 装置 C 中的烧瓶需要加热,其目的是使滴入烧瓶中的 SiHCl3 气化 C . 装置 D 中观察到的现象是有固体物质生成 D . 装置 D 可以采用普通玻璃管代替石英管 E . 为保证制备纯硅实验的成功,关键的操作步骤有检查实验装置的气密性,控制好反应温度以及排尽装置中的空气、干燥气体 F . 尾气处理装置中可以将导管直接插入盛有NaOH 溶液的烧杯中 -
(5) 为检验某粗硅中存在的铁元素,可采取的实验操作方法是
①酸性溶液中:Na+、ClO-、SO42-、I-
②无色溶液中:K+、Na+、MnO4-、SO42-
③碱性溶液中:Cl-、CO32-、SO42-、K+、AlO2-
④中性溶液中:Fe3+、K+、Cl-、SO42-
⑤由水电离出的c(OH-)=1×10-13mol·L-1的溶液中:Na+、Ba2+、Cl-、Br-
⑥与铝粉反应放出H2的无色溶液中:NO3-、Al3+、Na+、SO42-
 、
、  、
、  、
、  、I-中的几种,某同学为探究该溶液的组成进行了如下实验:
、I-中的几种,某同学为探究该溶液的组成进行了如下实验: Ⅰ.用铂丝醮取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到紫色火焰;
Ⅱ.另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成;
Ⅲ.取Ⅱ反应后溶液分别置于两支试管中,第一支试管中加入BaCl2溶液有白色沉淀生成,再滴加KSCN溶液,上层清液变红,第二支试管加入CCl4 , 充分振荡静置后溶液分层,下层为无色。
下列说法正确的是( )
 、
、  、I-
B . 为确定是否含有Cl- , 可取原溶液加入过量硝酸银溶液,观察是否产生白色沉淀
C . 步骤Ⅱ中红棕色气体是NO
D . 原溶液中肯定含有K+、Fe2+、
、I-
B . 为确定是否含有Cl- , 可取原溶液加入过量硝酸银溶液,观察是否产生白色沉淀
C . 步骤Ⅱ中红棕色气体是NO
D . 原溶液中肯定含有K+、Fe2+、  、
、 
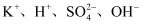 B .
B .  C .
C . 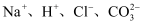 D .
D . 
| 阳离子 | Na+、Ca2+ 、Fe3+、Fe2+、Al3+、Mg2+ |
| 阴离子 | OH-、 |
 或
或  中的一种或两种都有
B . 溶液X 中是否有Na+不能确定,需通过焰色反应来确定
C . 溶液X 中可能有2 种阳离子,3 种阴离子
D . 原溶液一定没有Al3+、Fe 3+ , 但Na+,、
中的一种或两种都有
B . 溶液X 中是否有Na+不能确定,需通过焰色反应来确定
C . 溶液X 中可能有2 种阳离子,3 种阴离子
D . 原溶液一定没有Al3+、Fe 3+ , 但Na+,、  不确定
不确定
-
(1) 乙烯的电子式,结构简式。
-
(2) 鉴别甲烷和乙烯的试剂是(填序号)。
a.稀硫酸 b.溴的四氯化碳溶液 c.水 d.酸性高锰酸钾溶液
-
(3) 下列物质中,可以通过乙烯加成反应得到的是(填序号)。
a.CH3CH3 b.CH3CHCl2 c.CH3CH2OH d.CH3CH2Br
-
(4) 已知 2CH3CHO+O2
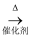 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示:
2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示:
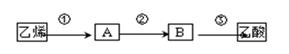
反应②的化学方程式为。 工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,其反应的化学方程式为,反应类型是。




